
 银氨溶液可用于检测CO气体,实验室研究的装置如图:
银氨溶液可用于检测CO气体,实验室研究的装置如图:分析 (1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,C元素的化合价不变,甲酸脱水;
(2)A中软管可使下方生成的气体的气压转移到液体的上方;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,与b对比;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中反应生成碳酸铵;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,遵循电子守恒.
解答 解:(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,C元素的化合价不变,甲酸脱水,则体现浓硫酸的脱水性,
故答案为:脱水性;
(2)A中软管可使下方生成的气体的气压转移到液体的上方,即其作用为恒压,使甲酸溶液能顺利滴下,
故答案为:恒压,使甲酸溶液能顺利滴下;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,为b、c的对比试验,排除银氨溶液对产物检验的干扰,
故答案为:对比试验,排除银氨溶液对产物检验的干扰;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中HCOOH与银氨溶液反应生成碳酸铵,所以上层清液中产物成分为(NH4)2CO3或NH4+、CO32-,
故答案为:(NH4)2CO3或NH4+、CO32-;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮,则证明黑色固体的成分是Ag的方法为取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银,
故答案为:滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体为单质银;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵,该离子反应为Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+,
故答案为:Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,消耗6.6g羟氨,n(NH2OH)=$\frac{6.6g}{33g/mol}$=0.2mol,由电子守恒可知,理论上可得银的质量为 $\frac{0.2mol×[0-(-1)]}{(1-0)}$×108g/mol=21.6g,
故答案为:21.6.
点评 本题考查性质实验方案的设计,为高频考点,题目难度中等,把握甲酸中含-CHO与银氨溶液的反应及产物的检验设计为解答的关键,试题侧重考查学生的分析能力、计算能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA | NaOH | 混合后溶液的pH |
| 甲 | C(HA)=0.2mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=a |
| 乙 | C(HA)=c1mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=7 |
| 丙 | C(HA)=0.1mol•L-1 | C(NaOH)=0.1mol•L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
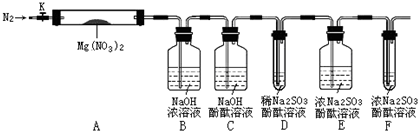
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
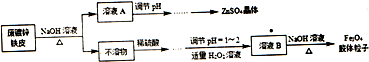
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、NO3-、Cl- | B. | Na+、Ba2+、Br-、SO32- | ||
| C. | H+、Na+、SiO32-、Cl- | D. | H+、Fe3+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
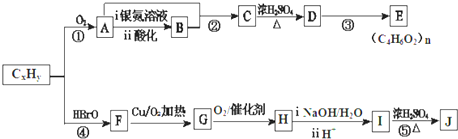
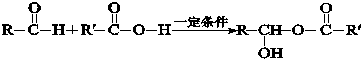
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成. |
| E | ①由C、H、O三种元素组成;②球棍模型为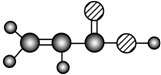 |
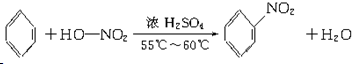 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com