
【题目】[化学一一选修3:物质结构与性质]碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是__________,该能级的电子云轮廓图为______________。金属Ge晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于__________晶体。
(2)①(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为______________,(CH3)3C+中碳骨架的几何构型为____________________。
②治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______(填标号)
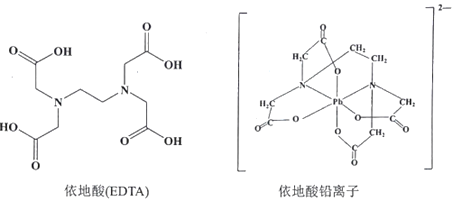
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(3)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________________________。
(4)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
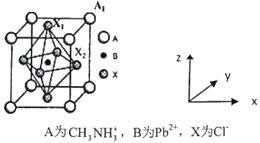
①若该晶胞的边长为anm,则Cl-间的最短距离是____________________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于_________位置。原子坐标参数B为(0,0,0);A1为(1/2,1/2,1/2),则X2为_________________。
【答案】 4p 哑铃形 原子 sp2、sp3 平面三角形 BC 金属阳离子半径越大,金属氧化物晶格能越低,碳酸盐分解生成的氧化物越不稳定 ![]() anm 棱心 (1/2,0,0)
anm 棱心 (1/2,0,0)
【解析】本题综合考查物质结构与性质,涉及到的考点有杂化轨道理论、晶胞计算、核外电子的排布等。(1)Ge元素的原子序数为32,其基态原子的核外电子排布为[Ar]3d104s24p2,核外电子占据最高能级的符号4p;p能级的电子云轮廓图为哑铃形;金刚石属于原子晶体,金属Ge晶胞结构与金刚石类似,沸点2830℃,锗晶体属于原子晶体;(2)①(CH3)3C+中,—CH3中碳原子杂化方式为sp3,(CH3)3C+中C+原子价层电子对位(4+3-1)÷2=3,故杂化方式为sp2,其中有三个结合的基团,故(CH3)3C+中碳骨架的几何构型为平面三角形;②根据依地酸铅离子的结构和依地酸的结构,结合氮原子原子守恒,n(Pb2+):n(EDTA)=1:1,A项错误;依地酸中含有元素O、N、C、H,其电负性从大到小的顺序为O>N>C>H,B项正确;依地酸铅盐中含有离子键(依地酸铅离子与阴离子之间的作用力)和配位键(依地酸中的氮原子与Pb2+),C项正确;依地酸分子能与水分子形成分子间氢键,所以依地酸具有良好的水溶性,D项错误;(3)随着金属阳离子半径越大,金属形成的氧化物晶格能越低,碳酸盐分解生成的氧化物越不稳定,故其碳酸盐的热分解温度逐渐升高;(4)①根据有机卤化铅晶体结构可知,Cl—处于面心,故Cl-间的最短距离是![]() =
=![]() ;②根据提给图示可知,结合原子坐标参数B为(0,0,0)、A1为(1/2,1/2,1/2),X2为(1/2,0,0)。
;②根据提给图示可知,结合原子坐标参数B为(0,0,0)、A1为(1/2,1/2,1/2),X2为(1/2,0,0)。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
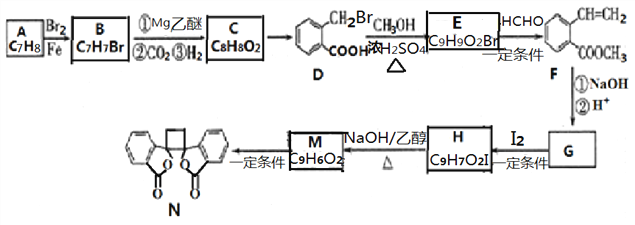
【题目】具有抗菌作用的白头翁素衍生物N的合成路线如下图所示:
已知: i. 
ii. 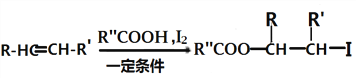
iii.  (以上R、R、R〞代表氢、烷基或芳基等)
(以上R、R、R〞代表氢、烷基或芳基等)
回答下列问题:
(1)物质B的名称是_______,物质D所含官能团的名称是_______ 。
(2)物质C的结构简式是_______。由C→D的反应类型为_______。
(3)由H生成M的化学方程式为_______。
(4)F的同分异构体中,符合下列条件的有______种(包含顺反异构),写出核磁共振氢谱有6组峰、面积比为1:1:1:2:2:3的一种有机物的结构简式____________。
条件:①分子中含有苯环,且苯环上有两个取代基②存在顺反异构
③能与碳酸氢钠反应生成CO2
(5)写出用乙烯和乙醛为原料制备化合物 的合成路线 (其他试剂任选)。________
的合成路线 (其他试剂任选)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.为汽车尾气的治理,环境工作者面临着巨大的挑战.试回答以下问题: 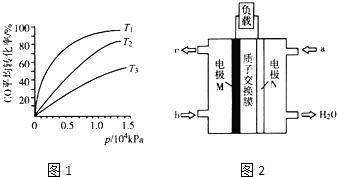
(1)用CH4催化还原NO,可以消除氮氧化物的污染.已知: ①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJmol﹣1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJmol﹣1
由CH4将NO2完全还原成N2 , 生成CO2和水蒸气的热化学方程式是 .
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2 , 已知某温度下,HNO2的电离常数K=﹣9.7×10﹣4 , NO2﹣的水解常数K=﹣8.0×10﹣10 , 则该温度下水的离子积常数=(用含Ka、Kb的代数式表示),此时溶液的温度25℃(填“>”“<”或“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为CO(g)+2H2(g)CH3OH(g)△H=﹣90.8kJmol﹣1 . 不同温度下,CO的平衡转化率与压强的关系如图1所示,图中T1、T2、T3的高低顺序是 , 理由是 .
(4)化工上还可以利用CH3OH生产CH3OCH3 . 在体积均为1.0L的恒容密闭容器中发生反应2CH3OH(g)CH3OCH3(g)+H2O(g).
容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
该反应的正反应为反应(填“放热”或“吸热”).若起始时向容器I中充入CH3OH 0.15mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向方向进行(填“正”或“逆”).
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为2CH3OH+3O2═2CO2+4H2O,电池工作时的示意图如图2所示.质子穿过交换膜移向电极区(填“M”或“N”),负极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL﹣1氨水中加入少量水,pH减小, ![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)==2C(g)+D(g),经2min后B的浓度减少0.6mol·L-1,下列说法正确的是
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 在2min末的反应速率,用B表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3:2:1
D. 在这2min内B和C两物质浓度是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molH2O的质量是18g
B.氮原子的质量就是氮的相对原子质量
C.1molH2SO4中含1molH2
D.氢氧化钠的摩尔质量是40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烧,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2═3CO2+4H2O.
(1)已知:2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1C(s)+O2(g)═CO2(g)△H2
2C(s)+O2(g)═2CO(g)△H3
则 C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(用△H1、△H2、△H3表示)
(2)写出该电池正极的电极反应式:,电池工作时CO32﹣移向(填“正极”或“负极”);用该电池电解1000mL lmol/L的AgNO3溶液(惰性电极),此电解池的反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各装置图的叙述中,不正确的是( )
A.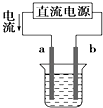 如图装置中a为阳极、b为阴极
如图装置中a为阳极、b为阴极
B.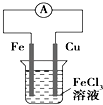 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.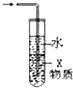 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 如图装置中的铁钉几乎不被腐蚀
如图装置中的铁钉几乎不被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com