
| A.①②④⑤ | B.①③⑤ |
| C.①②③④ | D.只有①③ |
科目:高中化学 来源:不详 题型:单选题
| A.2Na+2H2O═2NaOH+H2↑ | B.2H2O═2H2↑+O2↑ |
| C.2F2+2H2O═4HF+O2 | D.CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (1)Q单质的电子式为_______。
(1)Q单质的电子式为_______。 W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。 (2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。 (4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
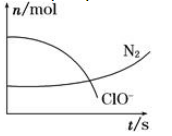
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO- , 还原产物是HCO3- |
| C.配平后氧化剂与还原剂的化学计量数之比为5∶2 |
| D.若生成2.24 L N2(标准状况),则转移电子0.5 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Li+中含有的中子数与电子数之比为2︰1 |
| B.在C2H6分子中极性共价键与非极性共价键数之比为6︰1 |
| C.常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1 |
| D.5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
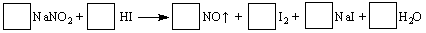
| A.③⑤ | B.①②④ | C.①②⑤ | D.①②③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开始加入合金的物质的量之和为0.3mol |
| B.反应中被还原和未被还原的硝酸物质的量之比为3∶1 |
| C.沉淀完全时消耗NaOH溶液的体积为200mL |
| D.生成沉淀的质量比原合金的质量增加10.2g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
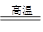 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C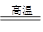 Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO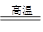 Pb+CO2。
Pb+CO2。| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
| D.将l mol PbS完全冶炼成Pb理论上至少需要6 g碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com