
【题目】无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图,主要步骤如下:

步骤1三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的作用是______,实验中不能用干燥空气代替干燥N2,原因是______。
(2)如将装置B改为装置C,可能会导致的后果是______。

(3)步骤3中,第一次过滤除去的物质是______。
(4)有关步骤4的说法,正确的是______。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
【答案】干燥管 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应 会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 镁屑 BD
【解析】
(1)仪器A为干燥管,空气中含氧气会和镁发生反应生成氧化镁,阻碍镁与溴单质的反应;
(2)将装置B改为C装置,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热存在安全隐患;
(3)反应完毕后恢复至常温,过滤除去固体为镁屑;
(4)根据物质的溶解性和实验操作目的分析判断。
(1)仪器A为干燥管,本实验要用镁屑和液溴反应生成溴化镁,所以装置中不能有能与镁反应的气体,如氧气,否则Mg与O2反应产生的MgO覆盖在Mg屑表面,会阻碍Mg和Br2的反应,因此不能用干燥的空气代替干燥的氮气;
(2)若将装置B改为C装置,当干燥的氮气通入,会使锥形瓶中气压变大,将液溴快速压入三颈瓶,反应过快,放出大量的热,存在安全隐患,装置B是利用干燥的氮气将溴蒸气带入三颈瓶中,可以控制反应速度,防止反应过快;
(3)步骤3过滤出去的是不溶于水的镁屑;
(4)A. 95%的乙醇中含有水,溴化镁有强烈的吸水性,因此不能使用95%的乙醇溶解样品,A错误;
B. 加入苯的目的是除去乙醚和溴,洗涤晶体用0℃的苯,温度降低,可以减少产品的溶解,B正确;
C. 加热至160℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为除去苯,C错误;
D. 该步骤是为了除去溶剂乙醚及可能残留的液溴,D正确;
故合理选项是BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr―→CH3—CHBr—CH3(主要产物)。1 mol某烃A充分燃烧后可以得到8molCO2和4mol H2O。该烃A在不同条件下能发生如图所示的一系列变化。下列说法正确的是( )
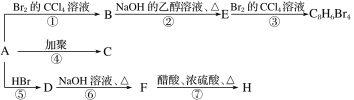
A.A的结构简式C8H10
B.C的结构简式![]()
C.D→F的反应类型是消去反应
D.B→E反应的化学方程式:![]() +NaOH
+NaOH![]()
![]() +NaBr
+NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”是建设美丽中国的发展方向。
(1) 已知:① CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1kJ/mol
② 2H2(g)+CO(g)=CH3OH(l) ΔH2=-128.3kJ/mol
③ 2H2(g)+O2(g)=2H2O(g) ΔH3=-481.9kJ/mol
常温下,在合适催化剂的作用下,采用CH4和O2一步合成液态CH3OH的热化学方程式为____。
(2) 二甲醚(CH3OCH3)是清洁能源。利用合成气合成二甲醚的原理是2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比n(H2)/n(CO)的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。
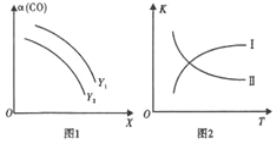
①图1中,X代表____;Y1____Y2 (填“>”“<”或“=”)。
②图2中,曲线____(填I或II)符合平衡常数变化规律。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2![]() 2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大)。请回答下列问题:
2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大)。请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→______→______→______→______→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式______。
(3)能证明反应中有CO生成的现象是______。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m g产品,置于蒸馏水中完全水解,并配成100 mL溶液。
②取10.00 mL溶液于锥形瓶中
③加入V1 mL浓度为c1mol/L AgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用c2 mol/LKSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为______,步骤④中达到滴定终点的现象为______。
(5)产品中氯元素的质量分数为______。
(6)下列操作,可能引起测得产品中氯含量偏高是______。
A.步骤③中未加硝基苯
B.步骤①中配制100 mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com