
 2NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在 800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2 的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化如图所示。请回答下列问题
2NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在 800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2 的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化如图所示。请回答下列问题

 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
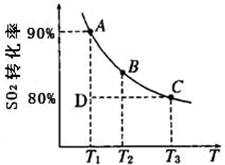 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上含有丰富的一种元素,氮及其化合物在公农业生产、生活中有着重
要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一。
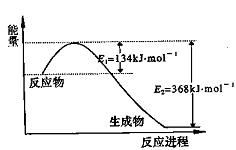
(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出
NO2和CO反应的热化学方程式: ;
又知:N2 (g)+2NO2 (g)=4NO(g) △H=+292.3kJ?mol―1,则反应:
2NO(g)+2CO(g) ![]() N2(g)+2CO2 (g)的△H为 ;
N2(g)+2CO2 (g)的△H为 ;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2 (g)+O2 (g) ![]() 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:
t(s) | 0 | 500 | 1000 | 1500 |
n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
① 写出该反应的平衡常数表达式:K= ,已知:![]() ,则该反
,则该反
应是 热反应;
② 反应达到平衡后,NO2的转化率为 ,此时若再通入一定量氮气,则NO2
的转化率将 (填“增大”、“减小”、“不变”);
③ 下图中表示N2O5的浓度的变化曲线是 ,
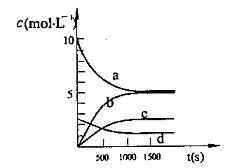
用O2表示从0~500s内该反应的平均速率v= 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
 2NH3(g)。图1表示在一定温度下反应过程中的能量变化,图2表示在2L密闭容器中反应时N2的物质的量随时间变化的曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。
2NH3(g)。图1表示在一定温度下反应过程中的能量变化,图2表示在2L密闭容器中反应时N2的物质的量随时间变化的曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com