
无水AlCl3是一种重要的有机合成催化剂,该
物质在183℃时升华,遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水AlCl3,实验装置如下图所示。
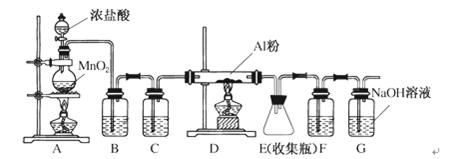
请回答下列问题:
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是________。
a.加入MnO2粉末 b.点燃A中酒精灯
c.加入浓盐酸 d.点燃D处酒精灯
(2)写出A装置中发生反应的离子方程式___________________________________。
(3)装置B中的试剂是__________。该装置存在安全隐患,请指出 。
(4)甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果。这种药品可以是______________。
(5)E中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学方程式表示其原因____________________________________________。
【知识点】本题考查制备实验方案的设计、铝的重要化合物.
【答案解析】(1)acbd (2)4H++2Cl-+MnO2=△=Cl2↑+2H2O+Mn2+ (3)饱和食盐水, DE间导管易发生堵塞(4)碱石灰(5)AlCl3+3H2O=Al(OH)3+3HCl↑
解析(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是a.加入MnO2粉末c.加入浓盐酸b.点燃A中酒精灯d.点燃D处酒精灯。(2)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,方程式为:MnO2+4HCl(浓)△MnCl2+Cl2 ↑+2H2O,离子方程式为:4H++2Cl-+MnO2═Cl2↑+2H2O+Mn2+;故答案为:4H++2Cl-+MnO2═Cl2↑+2H2O+Mn2+;(3)装置B中的试剂是饱和食盐水,该装置存在安全隐患DE间导管易发生堵塞(4)F和G的作用为除去装置中的水和CO2以及除去未反应的氯气,可以用干燥管中加入碱石灰来替代。(5)E中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学方程式表示其原因AlCl3+3H2O=Al(OH)3+3HCl↑
【思路点拨】本题主要考查了物质的制备,除杂和提纯,注意利用题目信息分析问题,培养了学生解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
以下关于物质的分类,正确的是( )
| 氧化物 | 酸 | 碱 | 盐 | |
| A. | Fe3O4 | CH3COOH | NH3·H2O | (NH4)2SO4 |
| B. | SO2 | H2SO4 | NaOH | Na2O2 |
| C. | CO | HNO3 | Cu2(OH)2CO3 | FeSO4 |
| D. | H2O | NaHSO4 | Ba(OH)2 | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下:
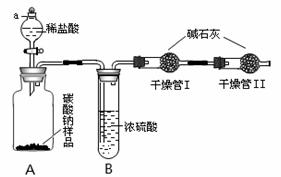
①按图将仪器组装好并检查气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1);③准确称量纯碱样品的质量(设为n),放入广口瓶A内;④打开分液漏斗a的旋塞,缓缓滴入稀盐酸,至不再产生气泡为止;
⑤称量干燥管Ⅰ的质量(设为m2)。
(1)实验操作④要缓缓地进行,其理由是________________。如果操作太快,会导致测定结果________(填偏大、偏小或不变)。
(2)装置B的作用是_____________________;干燥管Ⅱ的作用是_________________。
(3)根据甲同学的实验数据,写出计算纯碱样品纯度的公式_______________________
(4)方案评价:乙同学认为甲同学的方案有缺陷。乙同学认为稀盐酸要改为稀硫酸,否则会导致测定结果偏大。你认为还有其它缺陷吗?如果有,提出你的改进意见或需要添加的实验步骤,并指出甲同学缺少这一步骤会对结果产生什么影响(填偏大、偏小或不变),将答案填入表中(不一定要填满)。
| 序号 | 改进意见 | 缺少时的影响 |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
向物质的量相等的硫酸铝和硫酸铵溶于水形成的混合溶液中逐滴加入氢氧化钠溶液直至过量。下列表示氢氧化钠溶液加入的体积(X)与溶液中沉淀的量(Y)的关系示意图中正确的是( )
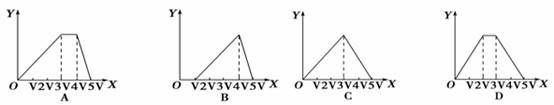
查看答案和解析>>
科目:高中化学 来源: 题型:
高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如下图),其实验流程如下:
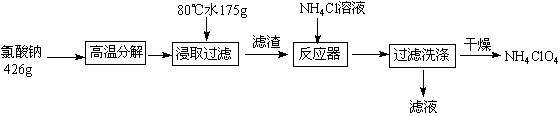
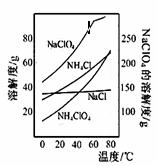
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为 。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为 (写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 。
(4)已知:2NH4ClO4  N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供下列试剂:
N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分步吸收或收集。
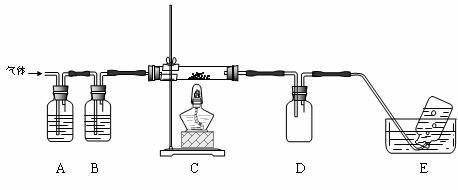
① E中收集到的气体可能是 (填化学式) 。
②装置D的作用可能是 。
③ A、B、C中盛放的药品依次可以是 (选填:Ⅰ、Ⅱ、Ⅲ)。
Ⅰ.a b d Ⅱ.c b e Ⅲ.b c f
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g铜镁合金完全溶解于50mL密
度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因
B.CH4、NH3、PH3的热稳定性逐渐增强
C.因为酸性:HC1>HF,所以非金属性:Cl>F
D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
| ||||||||||||||||
|
| ② |
| ③ | ④ | ⑤ | ⑥ |
| ||||||||||
|
| ⑦ |
| ⑧ |
|
|
|
| ||||||||||
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑤的轨道表示式_______,元素⑨原子的核外电子排布式__________。
(2)元素第一电离能的大小比较:④_____⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④_____⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式_________。
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(4)上述③与④元素组成的(CN)2化合物中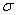 键与
键与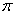 键之比________。
键之比________。
(5)⑦的氧化物是优良的耐高温材料,它的熔点比 CaO高,其原因是_____________。
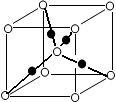
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
澳大利亚研究人员最近开发出被称为第五形态的单质碳,这种新的碳结构称作“纳米泡沫”,下列说法正确的是( )
A.木炭和石墨不属于碳元素的同素异形体
B.石墨能导电,木炭有吸附能力;纳米泡沫碳与金刚石互为同素异形体
C.造成金刚石和石墨物理性质的差异是由于组成两种物质的元素不同
D.C60是一种新化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com