
【题目】火力发电厂释放出大量氮氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理.可实现绿色环保、低碳减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为______。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
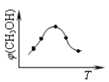
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图),则上述CO2转化为甲醇反应的△H3______0(填“>”、“<”或“=”)。
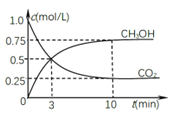
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:0~10min内,氢气的平均反应速率_____;第10min后,若升温,将使c(CH3OH)/c(CO2)_____(填“变大”、“减小”、“不变”);判断理由是_________;若向该容器中再充入1molCO2和3molH2,再次达到平衡时,则CH3OH(g)的体积分数将_________(“变大”、“减小”、“不变”)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为___________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由小到大的顺序为________________。
【答案】 CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol < 0.225mol/(L·min) 减小 由于正反应△H2<0,升高温度导致平衡逆反应进行。c(CH3OH)减小,c(CO2)增大,故c(CH3OH)/c(CO2) 减小 变大 4SO2+4NO2+12NH3+3O2+6H2O==4(NH3)2SO4+4NH4NO3 c(H+)<c(OH-)<c(NH3·H2O)<c(NO3-)<c(NH4+)
【解析】(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJmol-1,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJmol-1,则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=![]() (-574kJmol-1-1160kJmol-1)=-867kJ/mol故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(-574kJmol-1-1160kJmol-1)=-867kJ/mol故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(2)①根据图是内容知道:温度升高,甲醇的体积分数φ(CH3OH)减小,平衡逆向移动,所以反应是放热的,即△H<0,故答案为:<;②0~10min内,二氧化碳的平均反应速率=![]() =0.075mol/(Lmin),所以氢气的反应速率是3×0.075mol/(Lmin)=0.225mol/(Lmin),②根据图像,升高温度,c(CH3OH)减小,平衡逆向移动,说明△H2<0,则c(CH3OH)/c(CO2)减小;向该容器中再充入1molCO2和3molH2,会使得压强增大,平衡正向移动,所以则再次达到平衡时CH3OH(g)的体积分数变大,故答案为:0.225;减小;由于正反应△H2<0,升高温度导致平衡逆反应进行。c(CH3OH)减小,c(CO2)增大,故c(CH3OH)/c(CO2) 减小;变大;
=0.075mol/(Lmin),所以氢气的反应速率是3×0.075mol/(Lmin)=0.225mol/(Lmin),②根据图像,升高温度,c(CH3OH)减小,平衡逆向移动,说明△H2<0,则c(CH3OH)/c(CO2)减小;向该容器中再充入1molCO2和3molH2,会使得压强增大,平衡正向移动,所以则再次达到平衡时CH3OH(g)的体积分数变大,故答案为:0.225;减小;由于正反应△H2<0,升高温度导致平衡逆反应进行。c(CH3OH)减小,c(CO2)增大,故c(CH3OH)/c(CO2) 减小;变大;
(3)某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1:1,反应的化学方程式为4SO2+4NO2+12NH3+3O2+6H2O==4(NH3)2SO4+4NH4NO3;在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,氨水的电离程度大于硝酸铵的水解程度,则该溶液中微粒浓度由小到大的顺序为c(H+)<c(OH-)<c(NH3·H2O)<c(NO3-)<c(NH4+),故答案为:4SO2+4NO2+12NH3+3O2+6H2O==4(NH3)2SO4+4NH4NO3 ;c(H+)<c(OH-)<c(NH3·H2O)<c(NO3-)<c(NH4+)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】格林尼亚试剂简称“格氏试剂”,是有机卤化物与金属镁在无水乙醚或四氢呋喃(THF)中反应制得,在有机合成中用途广泛。反应原理如下:
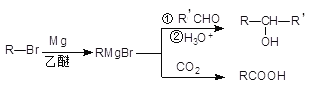
由A( ![]() )合成 I (
)合成 I ( ![]() )的流程图:
)的流程图:

(已知:NBS为溴化试剂,在一定条件下能与烯烃作用生成溴代烯烃。)
(1) 物质A的名称为_________________;由A生成B的反应类型是_________;
(2) 写出由A制备 ![]() 的化学方程式_________________________;
的化学方程式_________________________;
(3) 四氢呋喃是一种优良的溶剂,可由呋喃( ![]() )加氢得到,则四氢呋喃的结构简式为_____________________;
)加氢得到,则四氢呋喃的结构简式为_____________________;
(4) 写出由G生成H的化学方程式_____________________________________;
(5) 写出符合下列要求的I的同分异构体的结构简式_____________________;(写出一种即可,同一碳上不能连接2个羟基)
① 芳香族化合物 ② 二元醇 ③ 分子中有5种化学环境的H
(6) 参照上述信息,以A和A制得的环己酮( ![]() )为原料合成
)为原料合成![]() (
(![]() )______________________。
)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱完全中和时
A. 酸和碱的物质的量一定相等
B. 酸所提供的H+与碱提供的OH-的物质的量相等
C. 酸和碱的物质的量浓度相等
D. 溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度下,将一定量的氢气和氮气的混合气体充入等压密闭容器中进行反应,达到平衡时维持温度不变,测得混合气体的密度是反应前密度的1.25倍,则达到平衡时,氨气的体积分数为
A. 25% B. 27.5 % C. 30% D. 37.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题。
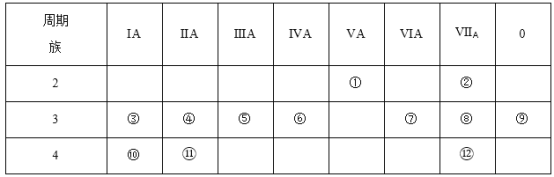
(1)写出下列元素符号:①__________,⑥__________,⑦__________,__________。
(2)在这些元素中,最活泼的金属元素是__________(填元素符号,下同),最活泼的非金属元素是__________,最不活泼的元素是__________。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________(填化学式,下同),碱性最强的是__________,呈两性的氢氧化物是__________,写出这三者之间相互反应的化学方程式__________。
(4)在这些元素中(稀有气体元素除外),原子半径最小的是__________(填元素符号,下同),原子半径最大的是__________。
(5)在③与④中,相应单质化学性质较活泼的是__________(填元素符号),怎样用化学实验证明?__________。在⑧与中,相应单质化学性质较活泼的是__________(填元素符号),怎样用化学实验证明?_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3N是科学家制备的新化合物,它可以和水反应生成两种碱性物质,其中一种A可以发生下列转化关系(A、B、C、D为中学常见物质且均含有同一种元素,反应条件及其他物质已经略去):
A![]() B
B![]() C
C![]() D
D
(1)Na3N中N的化合价为_______;
(2)写出Na3N和水反应的化学方程式_______;
(3)写出C→D的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①硫磺;②FeS2;③CuSO45H2O;④FeSO47H2O;⑤CaSO42H2O,其中可用于制硫酸的是
A. 只有② B. ①和② C. ①②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家冶炼出了纯度高达99.9999%的铁,根据你的推测,下列性质它不可能具有的是
A.硬度比生铁低 B.在潮湿的空气中放置不易生锈
C.在冷的浓硫酸中可以钝化 D.与4mol/L盐酸反应的速率比生铁快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com