
| A. | BaCl2、稀硝酸 | B. | AgNO3、稀硝酸 | C. | 稀盐酸、BaCl2 | D. | AgNO3、稀盐酸 |
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
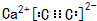 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 molCH3COOK含有3×6.02×1023个氢元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
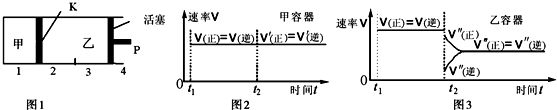
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com