
在常压和500℃条件下,等物质的量的Ag2O,Fe(OH)3 ,NH4HCO3 ,NaHCO3完全分解,所得气体体积依次是V1\V2\V3\V4.体积大小顺序正确的是
A.V3>V2>V4>V1 B. V3>V4>V2>V1
C.V3>V2>V1>V4 D.V2>V3>V1>V4
科目:高中化学 来源: 题型:
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2⇌ CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mLzxxk
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=3Al(l)+AlCl3(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式 。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
Mg17Al12+17H2=17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6.0mol·L-1HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 。
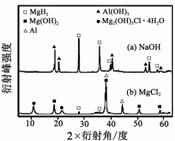 ③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,
混合物Y均只能部分放出氢气,反应后残留固体物质X-射线衍射谱图如右图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是
(填化学式)。
(3)铝电池性能优越,Al-AgO电池可用作水下
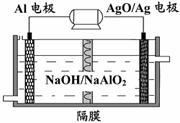 动力电源,其原理如右下图所示。该电池反应
动力电源,其原理如右下图所示。该电池反应
的化学方程式为:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.酸性(水溶液):HSCN > H2CO3 > HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质应用和组成的说法正确的是( )
A.P2O5可用于干燥Cl2和NH3
B.“可燃冰”主要成分是甲烷和水
C.CCl4可用于鉴别溴水和碘水
D.Si和SiO2都用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质分类的说法正确的是( )
A.金刚石、白磷都属于单质
B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质
D.葡萄糖、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)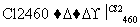 SiCl4
SiCl4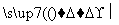 SiCl4(纯)
SiCl4(纯)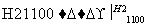 Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是()
A. 以石墨为电极,电解含甲基橙的0.1 mol/L硫酸溶液
B. 以铜为电极,电解1 mol/L硫酸溶液
C. 以石墨为电极,电解含酚酞的饱和食盐水
D. 以石墨为电极,电解1 mol/L溴化钾溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com