
| A. | 有质子的微粒一定有中子 | |
| B. | 通常所说的氢元素是指${\;}_{1}^{1}$H | |
| C. | 16O中的“16”表示氧元素的近似相对原子质量 | |
| D. | 根据反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O得到的Cl2,其相对分子质量为73.3 |
分析 A.${\;}_{1}^{1}$H只有质子;
B.氢元素含有三种同位素;
C.16O中16表示质量数;
D.该反应中Cl元素化合价由+5价、-1价变为0价,有$\frac{1}{6}$的HCl不作还原剂,起酸的作用,氧化剂是K35ClO3、还原剂 H37Cl.
解答 解:A.${\;}_{1}^{1}$H只有质子,没有中子,所以有质子的微粒不一定有中子,故A错误;
B.氢元素含有三种同位素,${\;}_{1}^{1}$H是氢元素的一种同位素,不能代表H元素,故B错误;
C.16O中16表示质量数,O元素有多种同位素,所以16O中的“16”不能表示氧元素的近似相对原子质量,故C错误;
D.该反应中Cl元素化合价由+5价、-1价变为0价,有$\frac{1}{6}$的HCl不作还原剂,起酸的作用,氧化剂是K35ClO3、还原剂 H37Cl,生成氯气的相对分子质量=$\frac{35×1+37×5}{3}$=73.3,故D正确.
故选D.
点评 本题考查了原子的构成、同位素、质量数与相对原子质量等,题目难度不大,侧重于考查学生对基础知识的应用能力.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题
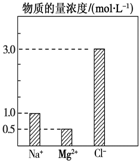 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2是还原产物 | |
| B. | O2F2中氧分子与氟分子比例为1:l | |
| C. | 每生成2.24LHF,转移0.4mol电子 | |
| D. | 氧化剂与还原剂的物质的量之比为l:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 | |
| B. | Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体 | |
| C. | Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 | |
| D. | NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{a+b}$ | B. | $\frac{a-b}{a+b}$ | C. | $\frac{a-b}{a}$ | D. | $\frac{a+b}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
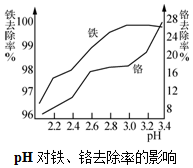 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com