
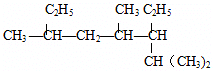 名称:2,4,6-三甲基-3-乙基辛烷
名称:2,4,6-三甲基-3-乙基辛烷 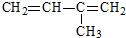 名称:2-甲基-1,3-丁二烯
名称:2-甲基-1,3-丁二烯
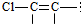 结构的有4种
结构的有4种 和
和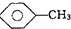 :KMnO4(H+)溶液.
:KMnO4(H+)溶液.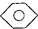 ,
,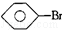 和C6H12(已烯):溴水.
和C6H12(已烯):溴水.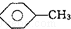 ,CCl4和乙醇:水.
,CCl4和乙醇:水. 分析 (1)判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
有机物的名称书写要规范;
对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;
(2)组成为C5H10的有机物,其所有同分异构体中属于烯烃,同分异构体说明含有1个C=C双键,根据碳链缩短法书写同分异构体;
(3)根据物质的量相同的烃(CXHY),完全燃烧,耗氧量取决于X+$\frac{Y}{4}$,X+$\frac{Y}{4}$越大,耗氧量越大;
(4)①甲苯能被高锰酸钾氧化,而苯不能;
②苯的密度比水小,溴苯的密度比水大,已烯与溴水发生加成反应;
③甲苯、四氯化碳不溶于水,分层现象不同.
解答 解:(1)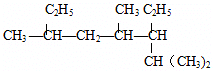 选取最长碳链为主碳链,含8个碳原子,离取代基近的一端编号,取代基位次和最小,得到名称为:2,4,6-三甲基-3-乙基辛烷,
选取最长碳链为主碳链,含8个碳原子,离取代基近的一端编号,取代基位次和最小,得到名称为:2,4,6-三甲基-3-乙基辛烷,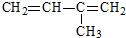 选取含碳碳双键的最长碳链,离双键近的一端编号,取代基位次和最小,得到名称为:2-甲基-1,3-丁二烯,
选取含碳碳双键的最长碳链,离双键近的一端编号,取代基位次和最小,得到名称为:2-甲基-1,3-丁二烯,
故答案为:2,4,6-三甲基-3-乙基辛烷;2-甲基-1,3-丁二烯;
(2)戊烷的同分异构体有CH3-CH2-CH2-CH2-CH3、 、
、 .
.
若为CH3-CH2-CH2-CH2-CH3,相应烯烃有CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3,
若为 ,相应烯烃有:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2,
,相应烯烃有:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2,
若为 ,没有相应烯烃,其中有三个-CH3的结构简式为:
,没有相应烯烃,其中有三个-CH3的结构简式为: ,丁烯有3种同分异构体,分别为:1-丁烯,2-丁烯和2-甲基-1-丙烯,其中满足题目要求的结构的1-丁烯有2种,2-丁烯有1种,2-甲基-1-丙烯有1种,故总共4种,
,丁烯有3种同分异构体,分别为:1-丁烯,2-丁烯和2-甲基-1-丙烯,其中满足题目要求的结构的1-丁烯有2种,2-丁烯有1种,2-甲基-1-丙烯有1种,故总共4种,
故答案为:5; ; 4;
; 4;
(3)设物质的量为1mol,
①甲烷耗氧量=1+$\frac{4}{4}$=2mol,
②2-甲基丁烷分子式C5H12,耗氧量=5+$\frac{12}{4}$=8mol,
③2-甲基-1-丁烯分子式C5H10,耗氧量=5+$\frac{10}{4}$=7.5mol,
④苯分子式C6H6,耗氧量=6+$\frac{6}{4}$=7.5mol,
⑤己烷分子式为C6H14,耗氧量=6+$\frac{14}{4}$=9.5mol,
⑥1-己烯分子式C6H12,耗氧量=6+$\frac{12}{4}$=9mol,
故答案为:⑤;
(4)①甲苯能被高锰酸钾氧化使其褪色,而苯不能,现象不同,可以鉴别,故答案为:KMnO4(H+)溶液;
②三种物质与溴水混合,苯的密度比水小,有机层在上层,而溴苯的密度比水大有机层在下层,已烯与溴水发生加成反应而使其褪色,现象不同,可以鉴别,
故答案为:溴水;
③三种物质与水混合,甲苯、四氯化碳不溶于水,分层现象不同,有机层在上层的为甲苯,在下层的为四氯化碳,乙醇与水混溶不分层,现象不同,可以鉴别,
故答案为:水.
点评 本题考查了有机物的命名、有机物燃烧耗氧量的比较、有机物的鉴别等知识,注意掌握烷烃的命名、苯的同系物的命名及简单的烃的衍生物的命名,命名时要遵循命名原则,书写要规范和常见有机物的性质及萃取现象为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 | |
| B. | 元素周期表中第IA族全部是金属元素 | |
| C. | 盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 | |
| D. | 硫在纯氧中的燃烧产物是三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g D2和足量O2反应可生成D2O 2NA个 | |
| B. | 98g H3PO4和H2SO4的混合物中含氢原子2.5NA个 | |
| C. | 6.02×1023个葡萄糖分子约含羟基6NA个 | |
| D. | 1molNa完全燃烧可转移电子NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由此可确定碘元素的相对原子质量为131 | |
| B. | $\stackrel{131}{53}$I是碘元素的一种同位素 | |
| C. | $\stackrel{131}{53}$I核素中含中子数为53 | |
| D. | $\stackrel{131}{53}$I2的摩尔质量为262 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com