
【题目】铁黑(Fe3O4)是常见的铁系颜料。一种制取铁黑的实验流程如图所示:

制取铁黑的反应原理可表示为:![]()
(1)保存FeSO4溶液时,常在试剂瓶中加入铁粉,其目的是______________________________。
(2)加入氨水调pH时,发生反应的离子方程式_______________________________________。
(3)Fe(OH)2在空气被氧化为Fe(OH)3,写出反应的化学方程式为__________________________。
【答案】防止Fe2+被氧化为Fe3+ ![]()
![]()
【解析】
硫酸亚铁溶液中加入氨水,亚铁离子在碱性条件下与氢氧根离子反应生成白色的氢氧化亚铁,继续滴加氨水并通入空气,生成的氢氧化亚铁会很快被氧化,变成灰绿色,最终氢氧化亚铁会被氧化成红褐色的氢氧化铁沉淀,最后过滤、洗涤、干燥并加热,获得铁黑(Fe3O4),结合铁及其化合物的性质分析解答。
(1)FeSO4具有还原性,可被空气中氧气氧化生成硫酸铁,加入铁粉,能够将氧化生成的硫酸铁还原为硫酸亚铁,防止硫酸亚铁被氧化,故答案为:防止Fe2+被氧化为Fe3+
(2)在FeSO4溶液中,加入氨水调pH至7~9时,生成氢氧化亚铁沉淀时发生反应的离子方程式为Fe2++2NH3H2O=Fe(OH)2↓+2NH4+,故答案为:Fe2++2NH3H2O=Fe(OH)2↓+2NH4+;
(3)Fe(OH)2在空气被氧化为Fe(OH)3,反应的化学方程式为4Fe(OH)2 + O2+ 2H2O=4Fe(OH)3,故答案为:4Fe(OH)2 + O2+ 2H2O=4Fe(OH)3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,回答下列问题:
A | B | |
C | D |
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1 mol气态氢化物对应的热量变化如下,其中能表示该主族第四周期元素的单质生成1 mol气态氢化物所对应的热量变化是______![]() 选填字母编号
选填字母编号![]() 。
。
![]() 吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。
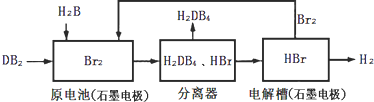
①查得:
化学键 | H-H | Br-Br | H-Br |
键能(kJ/mol) | 436 | 194 | 362 |
试写出通常条件下电解槽中发生总反应的热化学方程式:______。
②根据资料:
化学式 | Ag2SO4 | AgBr |
溶解度(g) | 0.796 | 8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到______,证明分离效果较好。
③在原电池中,负极发生的反应式为______。
④在电解过程中,电解槽阴极附近溶液pH______(填“变大”、“变小”或“不变”)。
⑤将该工艺流程用总反应的化学方程式表示为:________,该生产工艺的优点有_____(答一点即可);缺点有____(答一点即可)。
(3)溴及化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入______,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为______。
(4)CuBr2分解的热化学方程式为:2CuBr2(s)![]() 2CuBr(s)+Br2(g)△H=+105.4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
2CuBr(s)+Br2(g)△H=+105.4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会______(填“增大”“不变”“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立70周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,利用下图所示的有机物X可生产S﹣诱抗素Y.下列说法不正确的是( )

A.1mol Y与1mol Br2反应的产物有4种
B.1mol Y与足量NaOH溶液反应,最多消耗3mol NaOH
C.1mol X最多能加成7mol H2
D.X可以发生氧化、取代、酯化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:

明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S![]() 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是_________________。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
A.粉碎固体混合物 B.降低温度 C.不断搅拌 D.缩短浸泡时间
(3)从水浸后的滤液中得到K2SO4晶体的方法是__________。
(4)步骤③电解的化学方程式是_______________,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:_________。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是_________________________________。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为______________________吨(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·l-1NaOH溶液。

请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_________________________________________。
(2)A溶液可选用________________________________________
(3)若实验中测得样品的质量为W g ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1 盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法正确的是( )

A.常温下,Kb(NH3·H2O)约为1×10-3
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机制药工业中常用以下方法合成一种药物中间体(G):


(1)G的分子式是___。
(2)化合物A中含氧官能团的名称为___。
(3)由C→D的反应类型为___;化合物E的结构简式为___。
(4)写出B→C的反应的化学方程式:___。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①能与新制Cu(OH)2在加热条件下反应生成砖红色沉淀,水解产物之一能与FeCl3溶液发生显色反应;
②核磁共振氢谱为四组峰,峰面积比为1∶2∶4∶9;
③分子中含有氨基。
(6)已知:RCN![]() RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备
RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备![]() 的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]() CH3CH2Cl
CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com