
 有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )
有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )| A. | X可以为丁酸,也可以为丙醇 | B. | C分子中的碳原子数最多为3个 | ||
| C. | C可能能发生银镜反应 | D. | X、Y互为同分异构体. |
分析 有机物A与B的分子式为C5H10O2,在酸性条件下可水解,则A、B应为酯,都生成C,且分别生成X和Y,则X和Y的分子式相同,结构不同,应为同分异构体.
如C为CH3OH,则X、Y可能分别为CH3CH2CH2COOH或CH3CH(CH3)COOH;
如C为乙醇,则X、Y只能为丙酸,不存在同分异构体;
如C为HCOOH,X、Y为CH3CH2CH2CH2OH、CH3CH2CHOHCH3等;
C还可能为CH3COOH,X、Y分别为CH3CH2CH2OH、CH3CHOHCH3;
如C为丙酸,则X、Y只能为乙醇,不存在同分异构体,以此解答该题.
解答 解:由上述分析可知,C为CH3OH、HCOOH、CH3COOH,符合图中转化,
A.C为甲醇时X为丁酸,C为乙酸时X为丙醇,故A正确;
B.由以上分析可知,C中的碳原子最多为2个,故B错误;
C.如C为HCOOH,含-CHO,可发生银镜反应,故C正确;
D.X和Y的分子式相同,结构不同,X、Y互为同分异构体,故D正确.
故选B.
点评 本题考查有机物的推断,为高频考点,注意根据框图中反应判断C、X、Y的可能组成为解答该题的关键,侧重分析与推断能力的考查,X、Y为同分异构体为解答中易忽略的地方,题目难度中等.


科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr的反应原理相似,且水的作用也相同的是
A.2AlCl3+3Na2S+6H2O=2Al(OH)3↓+3H2S↑+6NaCl
B.2F2+2H2O=4HF+O2↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
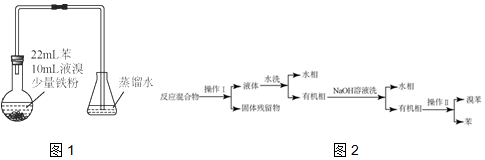
 .
.| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量 | ||
| 3 | 锥形瓶中液体含大量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 左室中NaOH的浓度不变 | |
| B. | 工作时,OH-向左迁移 | |
| C. | 右室电极反应为C2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D. | 右室生成CH3COONa1.5mol,理论上左室生成氢气67.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
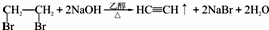 ;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$
;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )| A. | I表示的是滴定醋酸的曲线 | |
| B. | pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL | |
| C. | V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-) | |
| D. | V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
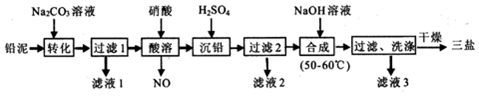
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com