
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
分析 (1)①C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
②CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
③S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
将方程式①-②-③得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=△H1-△H2-△H3;
(2)酸性燃料电池中,负极上燃料失电子生成二氧化碳和水;
(3)①参加反应的n(CO)=2mol-0.2mol/L×2L=1.6mol,转化率=$\frac{1.6mol}{2mol}×100%$;
②浓度商=$\frac{0.4}{0.1×0.{2}^{2}}$=100<160,平衡正向移动;
根据表中数据知,反应初始氢气浓度=0.2mol/L+0.4mol/L×2=1.0mol/L,
平衡时c(H2)=0.4mol•L-1,则参加反应的c(H2)=1mol/L-0.4mol•L-1=0.6mol/L,
则氢气的反应速率=$\frac{0.6mol/L}{10min}$=0.06mol/(L.min),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算甲醇反应速率;
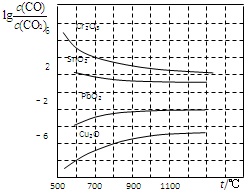
(4)相同温度下,lg[$\frac{c(CO)}{c(C{O}_{2})}$]越小,说明化学平衡常数越大,还原反应越容易;
根据图知,800℃时,lg[$\frac{c(CO)}{c(C{O}_{2})}$]=-6,则$\frac{c(C{O}_{2})}{c(CO)}$=106.
解答 解:(1)①C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
②CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
③S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
将方程式①-②-③得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=△H1-△H2-△H3=-393.5 kJ•mol-1-(+172.5kJ•mol-1-296.0kJ•mol-1)=-270kJ•mol-1 ,
故答案为:-270kJ•mol-1 ;
(2)酸性燃料电池中,负极上燃料失电子生成二氧化碳和水,电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+,
故答案为:CnH2nOn-4ne-+nH2O=nCO2+4nH+;
(3)①参加反应的n(CO)=2mol-0.2mol/L×2L=1.6mol,转化率=$\frac{1.6mol}{2mol}×100%$=80%,故答案为:80%;
②浓度商=$\frac{0.4}{0.1×0.{2}^{2}}$=100<160,平衡正向移动,则v正>v逆;
根据表中数据知,反应初始氢气浓度=0.2mol/L+0.4mol/L×2=1.0mol/L,
平衡时c(H2)=0.4mol•L-1,则参加反应的c(H2)=1mol/L-0.4mol•L-1=0.6mol/L,
则氢气的反应速率=$\frac{0.6mol/L}{10min}$=0.06mol/(L.min),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以甲醇反应速率为0.03mol/(L.min),
故答案为:>;0.03mol/(L.min);
(4)相同温度下,lg[$\frac{c(CO)}{c(C{O}_{2})}$]越小,说明化学平衡常数越大,还原反应越容易,所以Cu2O最容易被还原;
根据图知,800℃时,lg[$\frac{c(CO)}{c(C{O}_{2})}$]=-6,则化学平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$=106,
故答案为:Cu2O;106.
点评 本题考查化学平衡计算、盖斯定律计算、原电池原理等知识点,侧重考查计算能力及基本理论,这些知识点都是高频考点,会根据三段式法进行有关计算,知道浓度商、化学平衡常数与反应方向的关系,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | m+n>p | D. | C的质量分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁常用作红色油漆和涂料 | |
| B. | 司母戊鼎是青铜制品 | |
| C. | 光导纤维的主要成分是硅酸盐 | |
| D. | 常温下可用铁制或铝制容器盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
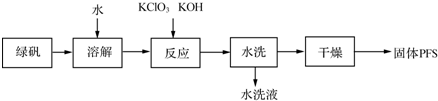
| 方法 | 双氧水氧化法 | 次氯酸钠氧化法 | 硝酸氧化法 |
| 原料 | 绿矾、硫酸、双氧水 | 绿矾、硫酸、次氯酸钠 | 绿矾、硫酸、浓硝酸等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
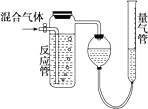 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 形成产物C和D的化学键放出的总能量高于断开反应物A和B的化学键所吸收的总能量 | |
| B. | 该反应只有在加热条件下才能进行 | |
| C. | 反应物的总能量高于产物的总能量 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=Z+A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com