
短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23。X 的原子半径比Y 的小,X 与W 同主族,Z 的最外层电子数是电子层数的3倍,M 是地壳中含量最高的金属元素。
(1)M的离子结构示意图____________,X、Y形成的含18电子的化合物的电子式____________
用电子式表示由W、Z形成的只含离子键的化合物的形成过程______________________
(2)Y、Z、M原子半径由大到小的顺序____________(用元素符号表示),Z的氢化物稳定性_____N的氢化物稳定性(填“>” “<”或 “=”)
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是_________(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:___________________________________________________________。
(4)由以上元素中两种或多种组成的化合物A、B、C、D有下列转化关系: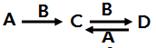
已知A溶液显碱性,可促进水的电离,用离子方程式表示A溶液显碱性的原因___________________,写出A与D反应的离子方程式______________________________。
(1) (1分)
(1分) 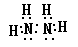 (1分)
(1分) (2分)
(2分)
(2)Al>N>O (2分) > (1分)
(3)H2O2 (1分) H2O2+CN-+OH-=CO32-+NH3 ↑ (2分)
(4) AlO2- +2H2O Al(OH)3 +OH- (2分) Al3 ++3AlO2- +6H2O ="4" Al(OH)3↓(2分)
Al(OH)3 +OH- (2分) Al3 ++3AlO2- +6H2O ="4" Al(OH)3↓(2分)
解析试题分析:短周期元素为从氢到氩,地壳中含量最高的金属元素为Al,故M为Al ;Z 的最外层电子数是电子层数的3倍,得知Z的电子层数为2,最外层电子数为6,故Z为O;X 的原子半径比Y 的小,说明X为H,X 与W 同主族,W的原子序数介于Z和M之间,得知W为Na, 原子最外层电子数之和为23,得知Y和N的最外层电子数之和为12,Y的最外层电子数只能小于6,故N为Cl,Y为N。
(1)X、Y分别为N、H,能形成的18电子化合物只可能是N2H4
(2)根据元素周期律,同周期元素半径逐渐减小,同主族元素半径逐渐增大,判断Al>N>O;O的非金属性大于Cl的非金属性,其氢化物稳定性大于Cl的氢化物稳定性。
(3)H和O既能形成共价键又能形成离子键的化合物只能是H2O2
(4)此题考查AlO2-、 Al(OH)3、 Al3 +三者相互转化的关系
考点:考查对元素周期律的理解及推理能力


科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素。A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式__________;F离子电子排布式为__________。
(2)写出X的化学式__________________________,化学名称为_________________。
(3)写出X涉及金属冶炼中的一个化学方程式_______________________________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:
________________________________________________________________________。
(5)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是_______________________________________
(6)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________(只要求列出算式)。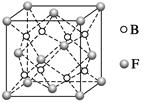
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族二~五周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1 c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:____________________________________;由R生成Q的化学方程式为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空。
| | | |||||
| | | | N | | F | |
| Mg | Al | | | S | Cl | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为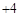 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
| pH t / min T / ℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元 素 | 性 质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题:
(1)同一周期元素的第一电离能从左到右总趋势是 (填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是 。(3)已知2号的I1=738KJ/mol, 则它的I2 738KJ/mol, I3 3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为( )
| A.3.5 | B.1.8 | C.2.5 | D.4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com