
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子( )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
饮用水中ClO2、 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时, 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:

2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时, 与I-反应的离子方程式__________________________。
与I-反应的离子方程式__________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加 入到锥形瓶中。
入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
【答案】
(1)方法二制备的ClO2中不含Cl2
(2)① +4H++4I-Cl-+2I2+2H2O
+4H++4I-Cl-+2I2+2H2O
②调节溶液的pH≤2.0
③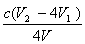
④Fe(OH)3
【解析】(1)分析问题时要了解有关知识。题干中明确指出用ClO2代替Cl2的优点,所以方法二优于方法一。
(2)①pH≤2.0,为酸性溶液,书写离子方程式时H+一定作为反应物。
②解答本题要弄清题意,前面在pH=7.0~8.0时,发生反应2ClO2+2I-====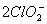 +I2,则后面要在pH≤2.0情况下实现转化
+I2,则后面要在pH≤2.0情况下实现转化 →Cl-,以便测定ClO2、
→Cl-,以便测定ClO2、 的含量,所以步骤⑤为调节溶液pH≤2.0。
的含量,所以步骤⑤为调节溶液pH≤2.0。
③pH=7.0~8.0,发生反应2ClO2+2I-====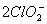 +I2
+I2
关系式:
2ClO2~I2 ~ 2Na2S2O3 ~ 2
c·V1·10-3 molc·V1·10-3 molc·V1·10-3 mol
pH≤2.0,发生变化 +4I-+4H+====Cl-+2I2+2H2O
+4I-+4H+====Cl-+2I2+2H2O
关系式:
 ~ 2I2~ 4Na2S2O3
~ 2I2~ 4Na2S2O3
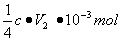 c·V2·10-3 mol
c·V2·10-3 mol
则c( )=
)=
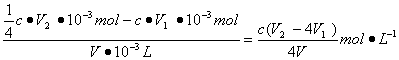


科目:高中化学 来源: 题型:
某烃的分子式为C11H20,1mol该烃在催化剂作用下可以吸收2mol H2;用酸性KMnO4溶液氧化,得到丁酮(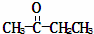 )、丙酮(
)、丙酮(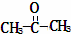 )和琥珀酸(
)和琥珀酸( )三者的混合物.该烃的结构简式为()
)三者的混合物.该烃的结构简式为()
A. 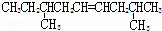 B.
B.  C.
C. 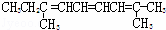 D.
D. 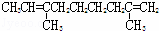
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
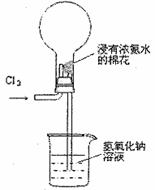
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
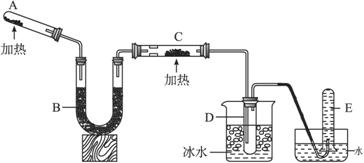
回答下列问题:
(1)A中加入的物质是_______________________,
发生反应的化学方程式是_______________________;
(2)B中加入的物质是____________,其作用是_______________________;
(3)实验时在C中观察到的现象是_______________________,发生反应的化学方程式是_______________________;
(4)实验时在D中观察到的现象是_________________,D中收集到的物质是____________,检验该物质的方法和现象是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
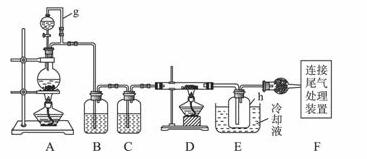
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl下标5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式____________。
(2)装置A中g管的作用是____________;装置C中的试剂是;装置E中的h瓶需要冷却的理由是____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
O3和H2O2都是常见的氧化剂,下列有关说法错误的是( )
A.O3和O2互为同位素
B.O3和H2O2的分子内都含有共价键
C.H2O2具有氧化性,可以用于消毒杀菌
D.高空中的O3层保护人类免受紫外线 伤害
伤害
查看答案和解析>>
科目:高中化学 来源: 题型:
研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
 ①SO2+NO2
①SO2+NO2 SO3+NO
SO3+NO
②SO3+H2O H2SO4
H2SO4
③2NO+O2 2NO2
2NO2
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
C.浓H2SO4滴入萤石中,加热 D.加入少量H2SO4使乙酸乙酯水解
查看答案和解析>>
科目:高中化学 来源: 题型:
以下一些氧化物和单质之间可发生如图所示的反应:
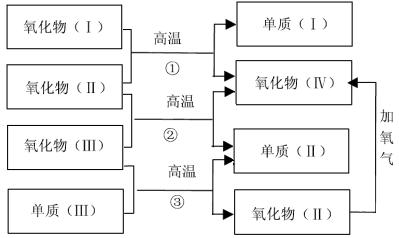
其中,氧化物(Ⅰ)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是 。
氧化物(Ⅱ)的化学式(分子式)是 。
(2)反应①的化学方程式是
。
反应②的化学方程式是 。
反应③的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com