
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiB.NaCl和HCl
C.CO2和H2OD.CCl4和KCl
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】化合物Ⅰ是有机合成中的一种重要中间体,具体合成过程如下(部分产物及条件略去):

①
②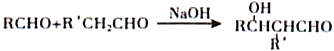
③![]()
④化合物A的一氯代物只有一种
(1)I分子中含有的官能团名称为________________________________。
(2)A→B的反应类型为__________________,G→H的反应类型为____________。
(3)D的化学名称为___________________________。
(4)C的结构简式为_________________,L的结构简式为_______________。
(5)G→J中过程①的化学方程式为_________________________,J→K的化学方程式为___________________________。
(6)同时满足下列条件的I的同分异构体有_________种(不考虑立体异构,不包括I)。
①与具有相同的官能团 ②具有六元碳环结构 ③分子中有一个甲基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是

A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。减少CO2排放是一项重要课题。
(1)以CO2为原料制取碳(C)的太阳能工艺如图所示。

①过程1中每生成1molFeO转移电子数为_______________。
②过程2中发生反应的化学方程式为___________________________。
(2)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120℃和催化剂条件下合成DMC。
已知:①CO的燃烧热为△H =﹣283.0 kJ·mol-1
②H2O(l)= H2O(g) △H = + 44.0 kJ·mol-1
③2CH3OH(g)+CO2(g)![]() CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g)![]() CH3OCOOCH3 (g)+ H2O(l) △H =_______________。
CH3OCOOCH3 (g)+ H2O(l) △H =_______________。
(3)在密闭容器中按n(CH3OH):n(CO2)=2:1投料直接合成DMC,一定条件下,平衡时CO2的转化率如图所示,则:

①v(A)、v(B)、v(C)由快到慢的顺序为____________________;
②K(A)、K(B)、K(C)由大到小的顺序为___________________;
③下列能说明在此条件下反应达到平衡状态的是__________。
A.2v正(CH3OH)= v逆(CO2) B.CH3OH与CO2的物质的量之比保持不变
C.容器内气体的密度保持不变 D.各组分的物质的量分数保持不变
(4)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
为分析催化剂对反应的选择性,在1 L密闭容器中充入1 molCO2和2 mol H2,测得有关物质的物质的量随温度变化如图所示。

①该催化剂在较低温度时主要选择________(填“反应Ⅰ”或“反应II”)。520℃时,反应II的平衡常数K=___________(只列算式不计算)。
②用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图所示。b电极上的电极反应式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,请据图回答下列问题:

(1)物质F的元素组成是____________。
(2)生物体内C的种类有__________种,其种类不同是由____________决定。现有一抗体G,它由4条肽链构成,共有764个氨基酸,则该抗体分子中至少含有游离的氨基______个。
(3)小麦种子细胞中,物质E主要是指________。相同质量的E和F彻底氧化分解,耗氧量较多的是________(填字母)。
(4)组成SARS病毒的小分子D是__________,是由____________、______________和____________构成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 加入少量CH3COONa晶体
C. 加少量冰醋酸 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸注入洁净的锥形瓶,并加入2-3滴酚酞试液
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________。
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,)______________。
(4)实验中用左手控制_________(填仪器及部位),眼睛注视_______,直至滴定终点。判断到达终点的现象是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32- + H2O ![]() HCO3-+ OH- 热的纯碱溶液清洗油污
HCO3-+ OH- 热的纯碱溶液清洗油污
B. Al3+ + 3H2O ![]() Al(OH)3(胶体)+ 3H+ 明矾净水
Al(OH)3(胶体)+ 3H+ 明矾净水
C. SnCl2 + H2O ![]() Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
D. TiCl4+ (x+2)H2O(过量) ![]() TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用pH试纸检测,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液;
a.溶液从酸性变为中性
b.溶液逐渐产生沉淀
c.沉淀完全溶解
d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除__________的存在。
(2)由②可以证明__________的存在;同时排除______的存在;理由是_______________。
(3)由③可以证明________的存在;写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示: c___________________________________________________ ;d___________________________________________________ 。
(4)由④可以排除__________的存在,同时证明________的存在。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com