
����Ŀ��������Ԫ��X��Y��Z��Q��R��ԭ��������������X��Y��Ԫ����������������֮�;�Ϊ0��Q��Xͬ���壻Z��R�ֱ��ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�ء�������ijЩԪ����ɵĻ�����A��B��C��D������ת����ϵ��![]() (��ˮ��Һ�н���)����֪C������ˮ�����Ե����壻D�ǵ���ɫ���塣���������������
(��ˮ��Һ�н���)����֪C������ˮ�����Ե����壻D�ǵ���ɫ���塣���������������
A.D�ĵ���ʽΪ��![]()
B.X��Y���γɶ��ֻ�������мȺ����Լ��ֺ��Ǽ��Լ�������Է���������С�����ʵķ���ʽΪ��C2H2
C.����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳���ǣ�Q>R>Y>Z>X
D.Aת��ΪB�����ӷ���ʽһ���ǣ�2AlO2-+3H2O+CO2��2Al(OH)3��+CO32-
���𰸡�D
��������
X��Y��Z��Q��R��ԭ������������������ֶ�����Ԫ�أ�X��Y��Ԫ����������������֮�;�Ϊ0����Q��Xͬ���壬��X��Q���ڢ�A�壬Y���ڢ�A�壬��XΪ��Ԫ�أ�QΪNaԪ�أ�YΪ̼Ԫ�أ�Z��R�ֱ��ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�أ���ZΪ��Ԫ�ء�RΪAlԪ�أ�������ijЩԪ����ɵĻ�����A��B��C��D������ת����ϵ��![]() (��ˮ��Һ�н���)�����У�C������ˮ�����Ե����壬��CΪCO2��D�ǵ���ɫ���壬��DΪNa2O2��AΪNaAlO2��BΪAl(OH)3��
(��ˮ��Һ�н���)�����У�C������ˮ�����Ե����壬��CΪCO2��D�ǵ���ɫ���壬��DΪNa2O2��AΪNaAlO2��BΪAl(OH)3��
A��DΪNa2O2������ʽΪ![]() ��A��ȷ��
��A��ȷ��
B��C��H�γɵĻ������мȺ����Լ��ֺ��Ǽ��Լ�������Է���������С�����ʵķ���ʽΪC2H2��B��ȷ��
C��Hԭ�Ӱ뾶��С��ͬһ����Ԫ�ش������ң�Ԫ�ص�ԭ�Ӱ뾶��С��ԭ�Ӻ�����Ӳ�Խ��ԭ�Ӱ뾶Խ�࣬��ԭ�Ӱ뾶Na>Al>C>O>H����Q>R>Y>Z>X��C��ȷ��
D���������̼��������Aת��ΪB�����ӷ���ʽ�����ǣ�AlO2-+2H2O+CO2=Al(OH)3��+HCO3-��D����
�ʺ���ѡ����D��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�����ؽṹ��ͼ���й�������ȷ����_____��ѡ����ţ���
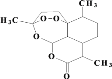
a����ѧʽΪC15H21O5 b��������NaOH��Һ��Ӧ
c��������ˮ d�����й��������н�ǿ������
��������Ϊԭ�ϳ��������岽�ϳɿɵõ������أ����е�2��Ϊ��ԭ��Ӧ��
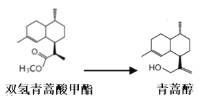
�����¼��ɷ�Ӧ���Է��ȣ���ԭ��ΪLiAlH4��������ʵ����ʣ�
���� | ���� |
˫�����������(C16H28O2) | ���壬������ˮ���������л��ܼ��� |
���ﴼ(C15H28O) | ���壬������ˮ���������л��ܼ��� |
���� | ��ɫҺ�壬����ˮ���ܶ�0.71g/cm3���е�34.6�档 |
�⻯��� | ���壬�������ѡ� ��ˮ��Ӧ��LiAlH4 + 4H2O ��Al(OH)3��+ LiOH +4H2�� �ɽ�һ��������ԭ�ɶ����Ӵ����������ɴ�������ﮡ� ����������﮿������ᷴӦ���������Ρ���κ���Ӧ�Ĵ����� |
ijѧϰС����ʵ������˫�������������ȡ���ﴼ��
(2)��Ӧ��ʹ�ù������⻯��ﮣ�������_____________________________________________��Ϊʹ��Ӧ����Һ״̬�½��У���������Ϊ�ܼ�������ˮ��������____________________��
(3)�����ʵ�����Ʊ�װ�ã�������ͼ����____________
(4)�÷�Ӧ�л����ת����ԼΪ96%������������Һ�к��д�ﮡ�������˫��������������⻯��ﮡ��ӷ�Ӧ���������ȡ���ﴼ�ķ����ǣ�
�ټ�_______���Һ��
�ڴ����Ѳ���ȡ���ﴼ���ж��ַ����������Ƕ��ַ�����
����һ�������ᾧ�� �������������������塣
a����2�����������������Ӧ�в���Һ��ԭ����___________________________________��
b�������2���������бȽ�_______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������þ��������ǿ��ڹ㷺������ȼ��������������ʯ(��ѧʽ��MgCO3CaCO3)Ϊԭ���Ʊ�������þ�Ĺ����������£�
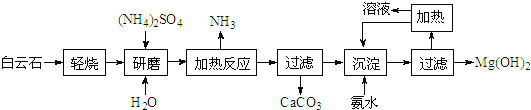
(1)��������ͼ������ʯ�������������������Ҫ�ɷ���MgO��_______(д��ѧʽ)��
(2)����ͼ�������ȷ�Ӧ���а������ɵĻ�ѧ����ʽΪ_________________________��
(3)ϴ��Mg(OH)2�������ò��������У�_______���ձ�������������ϴ���ķ�����____________��
(4)��ͳ�����ǽ�����ʯ���·ֽ�Ϊ����þ�������ƺ���ȡ�����ù��ղ������հ���ʯ�ķ��������ŵ���__________________��
(5)25��ʱMg(OH)2������Һ���У�c(Mg2+)=2.80��10��4mol/L��Mg(O2)22����Mg(OH)42����Ũ�ȹ�Ϊ2.35��10��4mol/L������Һ��pH=_______(ȡ����ֵ)��������ѭ�����ã�ÿ�Ƶ�5.8t Mg(OH)2ʱ�ų�200m3�ķ�ˮ������Mg2+��Mg(O2)22����Mg(OH)42����Ũ�ȹ�Ϊ1.50��10��4mol/L����ù��յIJ���Ϊ___________(����4λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���þ��Դ��Ϊ�ḻ�Ĺ���֮һ��
(1)��1molþ���Ͻ�(Mg17Al12)��ȫ�ܽ���12L 6mol/L�������У��ų�����______mol��Ϊʹ��Ӧ����Һ�е�Mg2+��Al3+��ȫ�����������10mol/L�İ�ˮ����______L��
(2)���ռ�ʽ̼��þ�ɵõ�MgO��ȡ��ʽ̼��þ4.66g�����������أ��õ�2g�����1.76g CO2��ijѧ��Ϊȷ����ʽ̼��þ�Ļ�ѧʽ���������������̣�
24+17x+60y+18z=4.66��(![]() )����
)����
2��x��2y=0����
(![]() )��(0.5x+z)��18=4.66��2��1.76����
)��(0.5x+z)��18=4.66��2��1.76����
(a)��ʽ������������ʽ̼��þĦ�������Ĺ�ϵʽ�����ʽ�������_______________��
(b)���Ϲ�ϵʽ����ȷ�ģ��ݴ˿�����ü�ʽ̼��þ�Ļ�ѧʽΪ________________________________��
(3)����þ��������������Ӧԭ��Ϊ��
MgO+H2O=Mg(OH)2 Mg(OH)2+SO2=MgSO3+H2O
MgSO3+H2O+SO2=Mg(HSO3)2 2MgSO3+O2=2MgSO4
ijС��ģ�������������(ʵ����25������)����MgO����ˮ�У����Ͻ��裬ͨ��SO2�Ϳ������õ�550g��Һ�����ɿ�������ȡ55g��Һ���μ��������������BaCl2��Һ���õ�0.897g��ɫ��������ȡ55g��Һ����������ˮ��BaCl2�����Һ���õ�1.992g��ɫ����������֪�����к�MgSO3 16.82g(�����ɷֲ�����Ԫ��)��
�ٸ�ʵ����������յ�SO2�����ʵ���Ϊ________mol���������������ʵ���Ϊ_______mol��
��Mg(HSO3)2������ˮ��25���ܽ�ȣ�MgSO4��33.7g/100gˮ��MgSO3��0.652g/100gˮ����ͨ������ȷ��550g��Һ��þ�εijɷּ����ʵ���(д���������)___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ��л��ܼ�M�߷��Ӳ���N��·����ͼ��
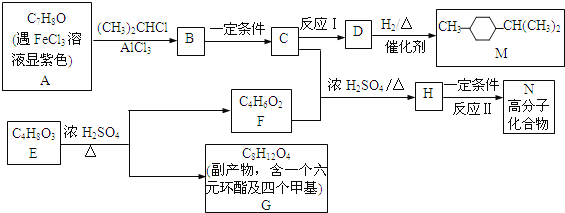
��֪�������廯���ﱽ���ϵ���ԭ�ӿɱ�±�����е����ȡ�����磺
![]()
(1)д����Ӧ���ͣ���Ӧ��__________ ��Ӧ��____________��
(2)д��D�ķ���ʽ___________��д��G�Ľṹ��ʽ_____________��
(3)д��E����F�Ļ�ѧ��Ӧ����ʽ______________________________��
(4)E��Ũ����������ת��ΪFʱ�������ɸ�����G���������ɸ߷��Ӹ����д���ø�����Ľṹ��ʽ____________________________��
(5)���������Һ���F��ͬ���칹���ж��֣�д������һ�ֵĽṹ��ʽ______________��
(6)д���߷��ӻ�����N�Ľṹ��ʽ_________________(��дһ��)��A��2�ֽṹ����ͨ������ʵ����ȷ����ȷ�ṹ���ö���ʵ���ͨ��A��__________(��д��������)��Ӧ��ʵ�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����˽̰�̲�ʵ�顰��200mL�ձ��з���20g���ǣ�C12H22O11������������ˮ��������ȣ�Ȼ���ټ���15mL��������Ϊ98%Ũ���ᣬѸ�ٽ��衱��������̽����
��1���۲����������ȱ�ƣ�����ڣ�������ͣ��γ����ɶ�ĺ���״��ɫ���ʣ�ͬʱ�ŵ��̼�����ζ����ѹ�˺�ɫ����ʱ���о���Ӳ������ˮ�г�Ư��״̬��ͬѧ�������������Ʋ�����н��ۣ�
��Ũ�������ǿ������ ��Ũ���������ˮ�� ��Ũ���������ˮ�Ԣ�Ũ����������� �ݺ�ɫ���ʾ���ǿ������
�������ݲ���ֵ���_________������ţ���
��2��Ϊ����֤������Ũ���ᷴӦ���ɵ���̬���ͬѧ�����������װ�ã�

�Իش��������⣺
��ͼ1��A�����ѡ������װ��_________�����ţ���
��ͼ1�� Bװ����װ�Լ���_________��Dװ�����Լ���������_________��Eװ���з�����������_________��
��ͼ1��Aװ����ʹ�����ȱ�ڵĻ�ѧ��Ӧ����ʽΪ_________����������͵Ļ�ѧ����ʽΪ��_________��
��ijѧ����ͼ2����ʵ��ʱ������DƿƷ�첻��ɫ��Eװ�����������ݳ���Fװ�������Ը��������Һ��ɫ��dz���Ʋ�Fװ�������Ը��������Һ��ɫ��dz��ԭ��_________���䷴Ӧ�����ӷ���ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100��ʱ����0.1 mol N2O4����1 L�ܱյ���ƿ�У�Ȼ����ƿ����100���ĺ��²��У���ƿ�ڵ�������Ϊ����ɫ��N2O4(g) ![]() 2NO2 (g)�����н��۲���˵��������Ӧ�ڸ��������Ѿ��ﵽ��Ӧ�ȵ����� ��
2NO2 (g)�����н��۲���˵��������Ӧ�ڸ��������Ѿ��ﵽ��Ӧ�ȵ����� ��
��N2O4������������NO2����������֮��Ϊ1��2����NO2������������NO2����������ȣ�����ƿ�������ѹǿ���ٱ仯������ƿ��������������ٱ仯����NO2�����ʵ���Ũ�Ȳ��ٸı䣻����ƿ���������ɫ���ټ������ƿ�������ƽ����Է����������ٱ仯������ƿ��������ܶȲ��ٱ仯��
A. �ڢۢޢ� B. �٢ܢ�
C. ֻ�Т٢� D. ֻ�Тߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����豶���������к��в��ӣ���������Ŀǰ�в����˹��ϳɵĴ���Ȼ����ܡ���Ч�ܵĿ������������ɻ������������е�ûʳ�Ӷ����أ�EGC���ṹ��ͼ��ʾ������EGC��������������ȷ���ǣ�������
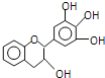
A.EGC�ķ���ʽΪC15H14O5�����ڷ����������
B.1molEGC��4molNaOHǡ����ȫ��Ӧ
C.�������ܹ�����ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ����ԭ��Ӧ����ɫ��Ӧ
D.���������е�ԭ�Ӵ���ͬһ��ƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʪ�����ֳ�Ϊ����������������������Һ��ͨ����������������ͬʱ�õ������ԭ����ͼ��ʾ��ͼ��HA��ʾ������ӣ�A����ʾ��������ӣ��� ����˵����ȷ���ǣ� ��.
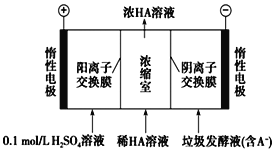
A.����11.2LO2����ʱ����·��ͨ��2 mol e���ĵ���
B.���ӴӸ������������Һ�ص�����
C.ͨ���A��ͨ�������ӽ���Ĥ������������Ũ����
D.ͨ�����������pH����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com