
【题目】短周期元素W.X、Y和Z在周期表中的相对位置如表所示,X原子的最外层电子数与电子层数相同。下列关系正确的是( )
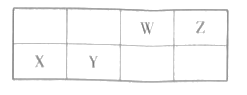
A.简单离子半径:X>W>Z
B.最高价氧化物对应水化物的酸性:Y>W
C.X.Y分别与2形成的二元化合物中化学键相同
D.工业上可用电解熔融的X2Z3制备X单质
【答案】D
【解析】
由短周期4种元素的相对位置可知,X在第三周期,X原子的最外层电子数与电子层数相同,则X原子的最外层电子数为3,则X为Al,根据相对位置可知,Y为Si,W为N,Z为O。
A.X、W、Z形成的简单离子分别为Al3+、N3-、O2-,它们核外电子排布相同;核外电子排布相同的离子,核电荷数越大,半径越小,则排序为N3-(W)> O2-(Z)> Al3+(X);A错误;
B.元素的非金属性越强,其最高价氧化物的水化物的酸性越强,Si的非金属性弱于N,则H2SiO3(Y)的酸性小于HNO3(W),B错误;
C.Al与O形成的化合物Al2O3,为离子化合物,只含有离子键;Si和O形成的化合物SiO2,是共价化合物,只有共价键,所含化学键类型不同,C错误;
D.工业上,电解熔融的Al2O3制备Al,D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】已知反应:2A(g)B(g)。分别取1molA于2L的固定体积的容器中,分别在T1和T2下,测得A的转化率随时间变化的关系曲线如图所示。下列说法正确的是

A.升高温度可缩短反应到达平衡的时间同时能提高A平衡的转化率
B.从反应开始至40min时,T2温度下生成B的物质的量比T1温度下多
C.图中a、b、c三点的化学反应速率依次减小
D.用B表示T1温度下前40min的平均反应速率:v(B)=0.0025molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥表示下列反应的电子转移方向和数目:
①Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O__________
②3Cl2+6KOH===5KCl+KClO3+3H2O_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ |
(1)⑤元素的原子结构示意图为_____________;
(2)③元素原子的最外层电子数为___________;
(3)⑤元素与④元素形成的离子化合物的化学式为_________(写出一种即可);
(4)②、③、④三种元素的非金属性逐渐___________(填“减弱”或“增强”);
(5)④元素和⑥元素形成的氢化物,其稳定性的强弱顺序为_______>_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
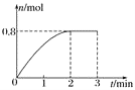
A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com