
已知25℃时,有关弱酸的电离平衡常数如下表:
化学式 | CH3COOH | HCN |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 |
下列有关说法正确的是( )
A.体积和pH相同的CH3COOH溶液与HCN溶液,分别与足量的Fe反应,HCN溶液产生的H2更多
B.体积和pH相同的CH3COOH溶液与HCN溶液,中和NaOH溶液所消耗NaOH的物质的量相同
C.amol·L-1HCN溶液加水稀释后,电离平衡常数减小,加入KCN晶体后,电离平衡常数增大
D.25℃时,在等浓度的CH3COOH溶液与HCN溶液中,水的电离程度前者大
科目:高中化学 来源:2017届江苏省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列说法正确的是( )
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
C.用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用
D.氢氧燃料电池、硅太阳能电池中都利用了原电池原理
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:填空题
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中:
(1)氧化剂是(填化学式) ,还原剂是(填化学式) 。
(2)在该反应中,若消耗了15.8g KMnO4,则转移了 mol 电子。
(3)用双线桥表示高锰酸钾和浓盐酸反应的电子转移方向和数目。
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:简答题
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中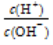 =________。
=________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积常数KW=____________,该温度____________25 ℃。(填“>”、“=”或“<”)
(3) 在(2)所述温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合。若所得混合液的pH=10,则Va∶Vb=___________。
(4) 常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在答题卷的图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
把0.05 mol NaOH固体分别加入到下列100 mL溶液中,导电能力变化较大的是 ( )
A.0.5 mol·L-1 MgSO4溶液
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1的CH3COOH溶液
D.0.5 mol·L-1 NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学试卷(解析版) 题型:填空题
在一容积为2 L的密闭容器内为加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
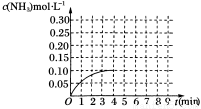
(1)根据上图,计算从反应开始到平衡时,平均反应速率υ(NH3)=___________ mol·L-1·min-1。
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填字母序号)。
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(3)该反应平衡常数K=____________。
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数____________(填“增大”、“减小”或“不变”)。
(5)在第5分钟 末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学试卷(解析版) 题型:选择题
以下反应可以用熵判据来解释的是( )
A.N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ/mol;
B.CaO(s)+CO2(g)==CaCO3(s)△H=-175.7kJ/mol
C.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol
D.2H2(g)+O2(g)==2H2O(l)△H=-285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑤⑥ B.①② C.②③⑤ D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com