
| A.水 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
 2CuO、CH3CH2OH+CuO
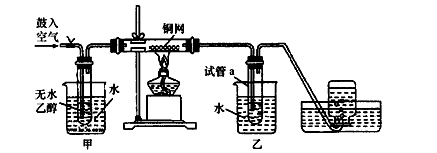
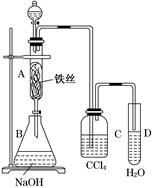
2CuO、CH3CH2OH+CuO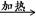 CH3CHO+Cu+H2O;放热;
CH3CHO+Cu+H2O;放热; 2CuO。当把热的Cu丝遇到乙醇蒸气时发生反应:CH3CH2OH+CuO
2CuO。当把热的Cu丝遇到乙醇蒸气时发生反应:CH3CH2OH+CuO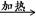 CH3CHO+Cu+H2O。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是放热反应,反应放出的热量就足够后面发生反应需要消耗的能量。(2)甲的水浴加热作用是产生乙醇蒸气,便于乙醇的挥发;而乙用的是冷水浴。目的是冷却降温,便于乙醛的收集。(3)由(1)的反应方程式可知:反应进行一段时间后,试管a中收集到的主要有机生成物是乙醛。若要检验试管a中能收集的该物质,可以利用醛基的性质进行的操作是加入新制的氢氧化铜悬浊液,加热煮沸若有砖红色沉淀产生,证明产物是乙醛;(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有酸性物质。在该该反应中产生的酸性物质只有乙酸CH3COOH。为除去乙酸。可以利用乙酸不同与乙醛的性质:有酸性,而且酸性比碳酸强,乙酸能跟碳酸盐发生反应消耗,同时生成的碳酸不温度,会分解,以气体的形式扩散。从而达到除杂的目的。反应的方程式为:NaHCO3+CH3COOH→CH3COONa+H2O+ CO2↑。选项为C。反应后的溶液为CH3COONa和乙醛的混合溶液。乙酸钠是离子化合物,熔沸点高,而乙醛的沸点较低,所以再通过蒸馏就可以除去乙酸钠,得到纯净的乙醛。
CH3CHO+Cu+H2O。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是放热反应,反应放出的热量就足够后面发生反应需要消耗的能量。(2)甲的水浴加热作用是产生乙醇蒸气,便于乙醇的挥发;而乙用的是冷水浴。目的是冷却降温,便于乙醛的收集。(3)由(1)的反应方程式可知:反应进行一段时间后,试管a中收集到的主要有机生成物是乙醛。若要检验试管a中能收集的该物质,可以利用醛基的性质进行的操作是加入新制的氢氧化铜悬浊液,加热煮沸若有砖红色沉淀产生,证明产物是乙醛;(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有酸性物质。在该该反应中产生的酸性物质只有乙酸CH3COOH。为除去乙酸。可以利用乙酸不同与乙醛的性质:有酸性,而且酸性比碳酸强,乙酸能跟碳酸盐发生反应消耗,同时生成的碳酸不温度,会分解,以气体的形式扩散。从而达到除杂的目的。反应的方程式为:NaHCO3+CH3COOH→CH3COONa+H2O+ CO2↑。选项为C。反应后的溶液为CH3COONa和乙醛的混合溶液。乙酸钠是离子化合物,熔沸点高,而乙醛的沸点较低,所以再通过蒸馏就可以除去乙酸钠,得到纯净的乙醛。

科目:高中化学 来源:不详 题型:填空题
| 物质 | 杂质 | 试剂 | 主要操作 |
| SiO2 | Fe2O3 | ______ | ______ |
| CO2 | CO | ______ | ______ |
| NaCl | MgCl2 | ______ | ______ |
| Cl2气体 | HCl | ______ | ______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
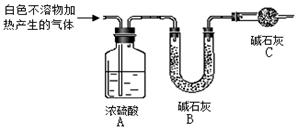
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为 ① |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② | ③ | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32-离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ① |
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |  |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 …… | ② …… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
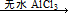 ArR+HX △H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示:
ArR+HX △H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示: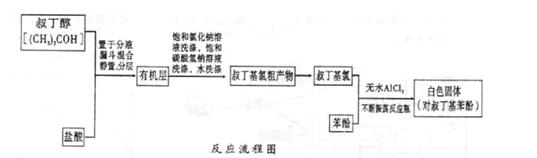
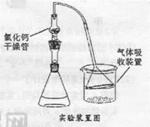
| 实验方案 | 实验现象 | 能否说明水解 |
| ①将锥形瓶中白雾通入HNO3酸化的AgNO3溶液 | | |
| ②将充分冒白雾后的液体抽滤,得不溶性固体,将固体分成两份, 。 | 两份固体均溶解 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用。 | |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤。 | |
| 步骤3:取少量步骤2得到的滤渣加入足量的盐酸。 | |
| 步骤4:取少量步骤2得到的的滤液,加入 。 | |
| 步骤5:往B试管中加入 。 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.量取待测橙汁的仪器水洗后未润洗 |
| B.锥形瓶水洗后未用待测液润洗 |
| C.滴定前尖嘴部分有一气泡,滴定终点时消失 |
| D.滴定前仰视读数,滴定后俯视读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com