
| A. | 反应中MnO2是氧化剂 | |
| B. | 该反应属于复分解反应 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
分析 3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O中,Mn元素的化合价由+4价升高为+6价,Cl元素的化合价由+5价降低为-1价,据此分析解答.
解答 解:A.Mn元素的化合价由+4价升高为+6价,所以MnO2是还原剂,故A错误;
B.3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O中,Mn元素的化合价由+4价升高为+6价,Cl元素的化合价由+5价降低为-1价,所以该反应属于氧化还原反应,故B错误;
C.Cl元素的化合价由+5价降低为-1价,所以KClO3在反应中得到电子,故C错误;
D.Mn元素的化合价由+4价升高为+6价,所以反应中每生成l mol K2MnO4,根据得失电子守恒,氧化剂得到(6-4)×1mol=2 mol电子,故D正确;
故选D.
点评 本题考查了氧化还原反应,明确基本概念内涵是解本题关键,根据元素化合价是否变化来分析解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 中国科学家屠呦呦成功提取出青蒿素用于治疗疟疾,挽救许人的生命 | |
| B. | 法国的让彼埃尔索瓦等三位科学家成功研制出分子机器 | |
| C. | 美国的三位科学家在拓扑相变领域的突出贡献 | |
| D. | 中国科学家蔡启瑞院士非酶催化剂合成氨以及化学方面突碳一出贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
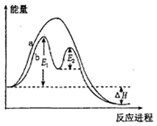
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为吸热反应 | |
| C. | 改变催化剂,可改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种化合物 | B. | 两种酸性氧化物 | ||
| C. | 两种化合物 | D. | 一种单质和一种化合物的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
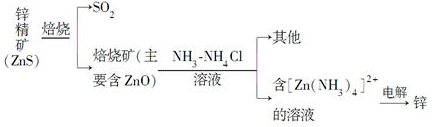
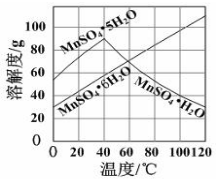
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
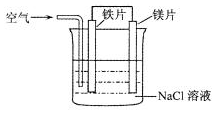
| A. | 镁片为负极,镁片上产生黄绿色气体 | |
| B. | 铁片为阳极,铁片上产生无色气体 | |
| C. | 溶液中铁片与镁片之间产生白色沉淀 | |
| D. | 溶液的pH将逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应 | |
| B. | 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多 | |
| C. | 合金的熔点一般比组成它的各成分的熔点都高 | |
| D. | 工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com