
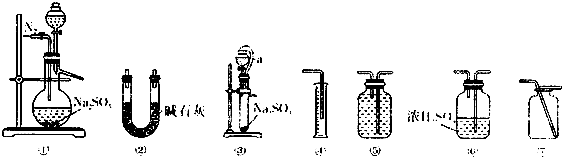
分析 (1)方案一:测定某Na2SO3样品的纯度,利用装置①②原理是样品和浓硫酸反应生成二氧化硫气体通过浓硫酸干燥后进入装置②被碱石灰吸收测定增重为二氧化硫质量,结合硫元素守恒计算纯度,为防止装置内空气中的二氧化碳、水蒸气干扰测定,需要开始通过氮气排净装置内空气,反应结束通氮气吧生成的二氧化硫全部排入碱石灰吸收;
反案二:选择装置③和④进行实验时,是利用排液体量气方法测定生成气体的体积,需要装置⑤,所盛溶液不能和二氧化硫发生反应,应选择饱和亚硫酸氢钠溶液,装置③中a 管的作用平衡压强使漏斗中液体顺利流下;
(2)①依据影响化学反应速率的因素分析判断选项;
②计算亚硫酸钠物质的量得到硫代硫酸钠物质的量,计算得到溶质质量,形成的饱和溶液溶质质量分数=$\frac{S}{100+S}$×100%,据此计算溶液质量,溶液体积V=$\frac{m}{ρ}$;
解答 解:(1)方案一:测定某Na2SO3样品的纯度,利用装置①②原理是样品和浓硫酸反应生成二氧化硫气体通过浓硫酸干燥后进入装置②被碱石灰吸收测定增重为二氧化硫质量,干燥装置选择③,导气管长进短出,结合硫元素守恒计算纯度,为防止装置内空气中的二氧化碳、水蒸气干扰测定,需要开始通过氮气排净装置内空气,反应结束通氮气吧生成的二氧化硫全部排入碱石灰吸收,;
故答案为:⑥;浓硫酸;反应前排净装置中的空气,反应后将装置中的SO2全部吹出;
方案二:选择装置③和④进行实验时,是利用排液体量气方法测定生成气体的体积,需要装置⑤,所盛溶液不能和二氧化硫发生反应,应选择饱和亚硫酸氢钠溶液,导气管短进长出,装置③中a 管的作用平衡压强使漏斗中液体顺利流下,
故答案为:⑤;饱和亚硫酸氢钠溶液;平衡压强使分液漏斗中的液体顺利滴下,并使测量结果更精确;
(2)①依据影响化学反应速率的因素分析判断选项,硫粉用少许乙醇和水浸润的目的是增大接触面积,加快反应速率,故选BD,
故答案为:BD;
②计算亚硫酸钠物质的量得到硫代硫酸钠物质的量=$\frac{20g}{126g/mol}$,硫元素守恒计算得到溶质硫代硫酸钠质量=$\frac{20g}{126g/mol}$×158g/mol,形成的饱和溶液溶质质量分数=$\frac{S}{100+S}$×100%=$\frac{212g}{100g+212g}$×100%,据此计算溶液质量=$\frac{\frac{20g}{126g/mol}×158g/mol}{\frac{212g}{212g+100g}×100%}$,溶液体积V=$\frac{m}{ρ}$=$\frac{20.0g×\frac{158g/mol}{126g/mol}×\frac{212g+100g}{212g}}{1.17g/c{m}^{3}}$=31.5cm3,
故答案为:$\frac{20.0g×\frac{158g/mol}{126g/mol}×\frac{212g+100g}{212g}}{1.17g/c{m}^{3}}$×100%=31.5cm3;
点评 本题考查了物质组成和成分纯度的实验过程分析和计算应用,主要是装置作用、试剂选择和装置连接,题目难度中等.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
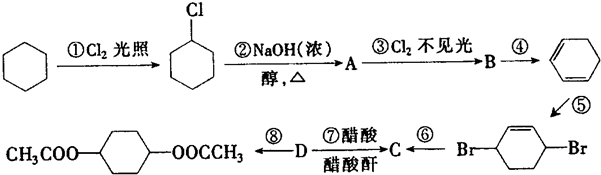
 ,C
,C .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为Br.
;元素⑩名称为Br.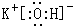 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
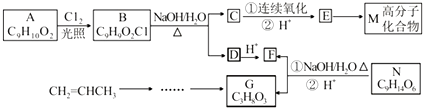
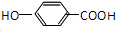 .
. .
.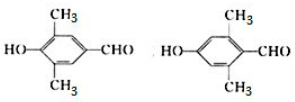 .
.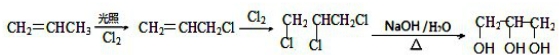 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
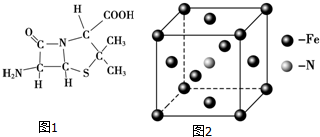
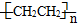 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量Cl2通入FeBr2溶液中:Cl2+2Br-═Br2+2Cl- | |
| B. | 将足量Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将少量Cl2通入FeI2溶液中:2Fe2++2I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 将672mLCl2(标况)通入250mL 0.1molL-1的FeI2溶液中:2Fe2++10I-+6Cl2═12Cl-+5I2+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开一个N≡N,同时有六个N-H键生成 | |
| B. | 生成氨的速率与分解氨的速率相等 | |
| C. | N2、H2,、NH3的质量分数不再变化 | |
| D. | 混合气体总压不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00- | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com