
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用药匙取少许样品于试管中,用滴管滴加适量的3mol•L-1H2SO4溶液,加热,充分反应后得到A溶液 | - |
| 步骤2:取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 若溶液变红色,样品中含+3价的铁元素 |
| 步骤3:另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 若溶液的紫红色褪去,样品中含+2价的铁元素 |

分析 (1)①稀硝酸具有强氧化性,不能利用硝酸溶解;
②检验铁离子用KSCN溶液,若变红色说明含有铁离子;检验亚铁离子,用高锰酸钾溶液,若高锰酸钾褪色,说明含有亚铁离子;
(2)①根据反应5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,可得出5Fe2+~MnO4-,消耗 MnO4-溶液体积为25.00mL时,求出反应的亚铁离子的物质的量,再求出250mL溶液中亚铁离子的物质的量和质量,再求质量分数;
②酸性溶液或强氧化性溶液应用酸式滴定管盛放;
③KMnO4溶液呈紫色,自身可以作指示剂.
解答 解:(1)①稀硝酸具有强氧化性,不能利用硝酸溶解,稀硝酸能将样品中+2价铁元素氧化为+3价,则不合理,
故答案为:不合理;稀HNO3具有强氧化性,能将样品中+2价铁元素氧化为+3价;
②检验铁离子用KSCN溶液,取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管,若溶液变红色说明含有铁离子;检验亚铁离子,用高锰酸钾溶液,另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管,若高锰酸钾褪色,说明含有亚铁离子;
故答案为:
| 实验操作步骤 | 预期现象与结论 |
| 取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 溶液变红色 |
| 另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 溶液的紫红色褪去 |
点评 本题考查了实验设计的基本原理和离子的检验方法、物质含量的测定实验方案设计,题目难度中等,侧重于考查学生的实验探究能力和计算能力,注意把握常见离子的检验方法.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.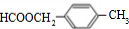 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )
对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )| A. | 浓硫酸在该反应中起着降低反应活化能和提高原料转化率作用 | |
| B. | 该反应属于消去反应 | |
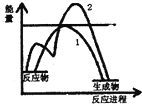
| C. | 如图表示放热反应的图象.曲线1表示未加催化剂, 则曲线2表示加了催化剂 | |
| D. | 该反应为放热反应,故升髙温度正反应速度减小,逆反应速度加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 煤的气化、石油分馏、海水制镁、海带提碘等过程中都包含化学变化 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝、羊毛和人造丝的主要成分都是蛋白质 | |
| D. | 甲苯能够被酸性高锰酸钾溶液氧化成苯甲酸,而甲烷不反应,说明苯环能够使甲基变活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
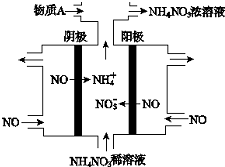
| A. | 阳极上的电极反应为:NO•3e-+4OH-=NO3-+2H2O | |
| B. | 电解生成1 mol NH4NO3 时,转移5NA电子 | |
| C. | 电解质溶液中,NO3-离子向阴极移动 | |
| D. | 为了使电解产物全部转化为NH4NO3,需补充的物质A为稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )
实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )| A. | ①②③⑤ | B. | ①②⑥ | C. | ③⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com