
【题目】丙烯腈(C3H3N)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下。
①C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
②C3H6(g)+O2(g)C3H4O(g)+H2O(g) ΔH=353 kJ·mol1
请回答下列各题:
(1)关于上述反应,下列说法正确的是____。
A.增大压强有利于提高丙烯腈平衡产率
B.反应②的ΔS等于零
C.可以选择合适的催化剂来提高混合气中丙烯腈的生产效率
D.上述反应在恒温、恒容密闭容器中进行,若H2O(g)浓度保持不变,则说明两反应均达到平衡状态
(2)一定温度下,在体积不变的容器中充入C3H6、NH3、O2各1mol,一定时间后反应达到平衡状态,测得容器内C3H6和H2O的物质的量分别为0.4mol和1.4mol,该温度下反应②的平衡常数为____。
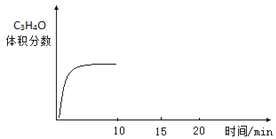
(3)若向容器内充入3mol C3H6和1mol O2只发生反应②,一定时间达到平衡状态,10min时再充入1mol O2,15min重新达到平衡,请在图中画出10min~20min内C3H4O的百分含量的变化图__________。
(4)如图为一定时间内丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。下列说法正确的是_____。

A.460℃之前产率随温度升高而增大是因为随温度升高反应平衡常数变大
B.高于460℃产率下降的原因可能是温度升高催化剂活性降低
C.460℃时C3H6的转化率一定大于500℃
D.温度过高副反应可能变多不利于合成丙烯腈
【答案】CD 3.5  BD
BD
【解析】
(1)关于上述反应的判断,按相关原理进行判断;
(2)按已知条件,结合三段式计算一定温度下反应②的平衡常数;
(3)在图中画出10min~20min内C3H4O的百分含量的变化图,抓住10 min、15 min瞬间C3H4O的百分含量即可;
(4)关于一定时间内丙烯腈产率与反应温度的关系曲线说法的判断,结合图示信息和相应原理判断即可;
(1)A. 生产丙烯腈的反应为:C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1,增大压强,平衡左移,则增压不利于提高丙烯腈平衡产率,A错误;
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1,增大压强,平衡左移,则增压不利于提高丙烯腈平衡产率,A错误;
B.反应②为C3H6(g)+O2(g)C3H4O(g)+H2O(g) ΔH=353 kJ·mol1,虽然气体分子数目不变,但各物质的熵不同,故ΔS不等于零,B错误;
C.可以选择合适的催化剂极大地提高反应速率,从而提高混合气中丙烯腈的生产效率,C正确;
D.上述反应在恒温、恒容密闭容器中进行,若H2O(g)浓度保持不变,则意味着一定时间内反应中生成水和消耗水的量相等,则说明反应①、②这两反应均达到平衡状态,D正确;
答案为:CD;
(2)已知一定温度下,在体积不变的容器中充入C3H6、NH3、O2各1mol,一定时间后反应达到平衡状态,测得容器内C3H6和H2O的物质的量分别为0.4mol和1.4mol,运用三段式进行计算如下:  ,
, ,则
,则![]() ,解得
,解得![]() ,则②C3H6(g)+O2(g)C3H4O(g)+H2O(g)的平衡常数
,则②C3H6(g)+O2(g)C3H4O(g)+H2O(g)的平衡常数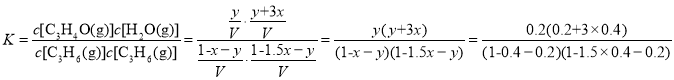 =3.5;
=3.5;
答案为:3.5 ;
(3)若向容器内充入3mol C3H6和1mol O2只发生反应②,一定时间达到平衡状态,10min时再充入1mol O2,则此瞬间C3H4O的百分含量下降,因为增大氧气浓度,平衡向右移动, 15min重新达到平衡,C3H4O的百分含量增大,则10min~20min内C3H4O的百分含量的变化图为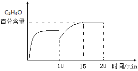 ;
;
答案为: ;
;
(4) 已知生产丙烯腈的反应为:C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1,则:
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1,则:
A. 460℃之前产率随温度升高而增大是因为随温度升高反应速率加快,同时生产丙烯腈的反应为放热反应,温度升高反应平衡常数变小,A错误;
B. 催化剂在一定温度范围内活性较高,若温度过高,活性降低,高于460℃产率下降的原因可能是温度升高催化剂活性降低、反应速率变慢,B正确;
C. 460℃时C3H6转化率不一定高于500℃,因为不明确是否处于平衡状态,C错误;
D.温度超过460℃时,产率下降,意味着可能有副反应,则温度过高副反应可能变多不利于合成丙烯腈,D正确;
答案为:BD。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断不正确的是
![]()
A. 最高正化合价:X<Y<Z
B. 原子半径:X<Y<Z
C. 气态氢化物的热稳定性:Z<W
D. 最高价氧化物对应水化物的酸性:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活息息相关。下列说法不正确的是
A.城市空气质量报告中,PM2.5、PM10指的是悬浮颗粒物,会影响人体健康
B.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”能提高空气质量
C.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D.氧化亚铁可以用作色素,如应用于瓷器制作中使釉呈绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止枪支生锈,常采用化学处理使枪支的钢铁零件表面生成Fe3O4的致密保护层— “发蓝”。化学处理过程中,其中一步反应为3Fe + NaNO2+5NaOH =3Na2FeO2+H2O+NH3↑。下列叙述不正确的是
A.该处理过程不会产生污染B.上述反应中铁被氧化
C.NO2-的氧化性大于FeO22-D.反应中转移2mole-,生成还原产物![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马尾藻和海带中都含丰富的碘,可从中提取碘单质,实验室选取常见的海带设计并进行了以下实验:

(1)操作①的名称为___________。
A.萃取 B.分液 C.蒸发结晶 D.过滤
(2)步骤③中所用的分液漏斗使用前须进行检漏,试简述其操作______。
(3)步骤②加入H2O2和H2SO4溶液,反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是
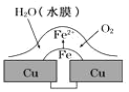
A.阳极电极反应式为:2H++2e→H2↑
B.此过程中电子从 Fe 移向 Cu,铁铆钉发生还原反应
C.此过程中铜会被腐蚀,发生氧化反应
D.此过程中铁做负极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题
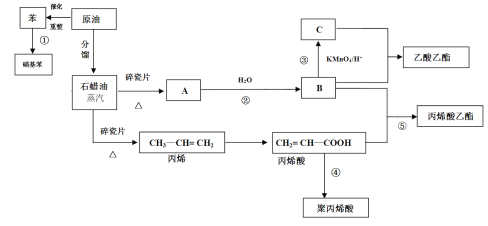
(1)C的结构简式为________。
(2)丙烯酸中含氧官能团的名称为_____________。
(3)③④反应的反应类型分别为_____________、___________。
(4)写出下列反应方程式
①反应①的化学方程式____________;
②反应②的化学方程式_________________;
③反应⑤的化学方程式____________。
(5)丙烯酸(CH2 = CH — COOH)可能发生的反应有_______________(填序号)
A 加成反应 B 取代反应 C 加聚反应 D 中和反应 E 氧化反应
(6)丙烯分子中最多有______个原子共面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com