
| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应的剧烈程度随核电荷数增加而增强 | |
| C. | 最高价氧化物对应水化物的碱性随核电荷数增加而增强 | |
| D. | 还原性随原子电子层数的增加而增加 |
分析 A.锂在空气中燃烧的生成物为氧化锂;
B.碱金属核电荷数越大,原子半径越大,失去电子的能力越强,金属性越强,单质还原性越强;
C.碱金属核电荷数越大,原子半径越大,失去电子的能力越强,金属性越强,碱金属元素最高价氧化物对应的水化物的碱性逐渐增强;
D.从上到下,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,金属性逐渐增强.
解答 解:A.锂在空气中燃烧的生成物为氧化锂,得不到过氧化物,故A错误;
B.碱金属随原子序数增加,电子层数的增加,失去电子的能力越强,金属性越强,单质还原性越强,与水反应的剧烈程度增强,故B正确;
C.碱金属元素从上到下随着原子序数的递增,单质的还原性逐渐增强,金属性增强,最高价氧化物对应水化物的碱性随核电荷数增加而增强,故C正确;
D.因同一主族从上到下,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,其单质的还原性增强,故D正确;
故选A.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的递变规律是解题的关键,注意物质的特殊性,题目难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
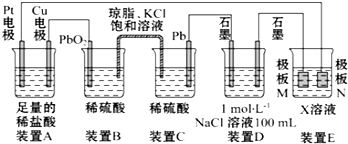
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14% | B. | 16% | C. | 11% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
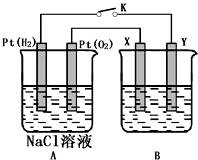 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:
某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
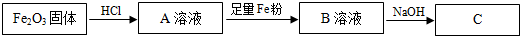
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com