
| A. | 150mL 1 mol/L氯化钠溶液 | B. | 75mL 2 mol/L氯化镁溶液 | ||
| C. | 50mL 3 mol/L氯化钾溶液 | D. | 50mL 1 mol/L氯化铁溶液 |
分析 每个氯化铝化学式中含有三个氯离子,所以1mol/L100mL氯化铝中n(Cl-)=1mol/L×0.1L×3=0.3mol,根据n=CV结合化学式计算氯离子物质的量.
解答 解:每个氯化铝化学式中含有三个氯离子,所以1mol/L100mL氯化铝中n(Cl-)=1mol/L×0.1L×3=0.3mol,A.该氯化钠溶液中n(Cl-)=1mol/L×0.15L×1=0.15mol,故A错误;
B.该溶液中n(Cl-)=2mol/L×0.075L×2=0.3mol,故B正确;
C.该溶液中n(Cl-)=3mol/L×0.05L×1=0.15mol,故C错误;
D.该溶液中n(Cl-)=1mol/L×0.05L×3=0.15mol,故D错误;
故选B.
点评 本题考查物质的量有关计算,为高频考点,明确n、C、V及化学式的关系是解本题关键,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol A、2mol B | 6mol A、4mol B | 2mol C |
| 到达平衡的时间(min) | 5 | 8 | |
| A的浓度(mol/L) | c1 | c2 | |
| C的体积分数 | w1 | w3 | |
| 混合气体密度(g/L) | ρ1 | ρ2 |
| A. | 若x<4,则2c1>c2 | |
| B. | 若x=4,则w3=w1 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | |
| D. | Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象是因为光的反射 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | NaOH溶液和AlCl3溶液 | ||
| C. | Fe和Cl2 | D. | NaOH溶液和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
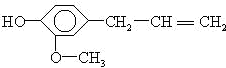 据此结构分析,下列说法正确的是( )
据此结构分析,下列说法正确的是( )| A. | 可以燃烧,只能与溴水发生加成反应 | |
| B. | 可与NaOH溶液反应,也可与FeCl3溶液反应 | |
| C. | 不能与金属钠反应放出H2 | |
| D. | 可以与小苏打溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | 0.5H2SO4(aq)+0.5Ba(OH)2(aq)═0.5BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com