
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
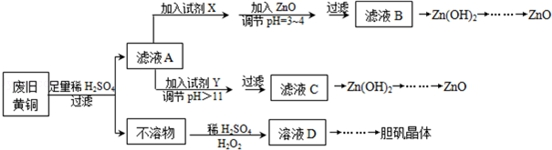
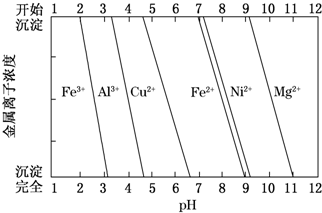
分析 用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO,废旧黄铜加入过量稀硫酸过滤得到不溶物E为Cu,滤液A为硫酸亚铁、硫酸锌,滤液A中加入过氧化氢氧化剂氧化亚铁离子为铁离子,加入氧化锌调节溶液PH3.0--5.9铁离子全部沉淀,锌离子不沉淀,过滤得到滤液中加入碱溶液沉淀锌离子生成氢氧化锌,灼烧得到氧化锌;或滤液A中加入过量试剂Y为氢氧化钠溶液,亚铁离子全部沉淀,过滤后的滤液中为Na2ZnO2,加入酸反应生成氢氧化锌沉淀,灼烧得到氧化锌;不溶物E中通入氧气同时加入稀硫酸溶液反应生成硫酸铜溶液,蒸发浓缩,冷却结晶得到硫酸铜晶体,
(1)试剂X的作用是氧化亚铁离子生成铁离子,同是又不能引入新的杂质,据此答题;
(2)根据题中提供的几种离子生成氢氧化物沉淀的pH可知,调节溶液pH,降低溶液酸度,可以使铁离子全部沉淀,从而除去;
(3)酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水;
(4)依据从溶液中得到固体需要蒸发浓缩、冷却结晶以及抽滤等回答;
(5)此过程需要调节pH值大于11,故可以加入强碱;pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-,类似与偏铝酸根,加入酸,先生成氢氧化锌沉淀,继续加入酸,沉淀溶解;
(6)①根据相关反应的方程式,可得到关系式2Na2S2O3 ~2Cu2+,根据反应的关系式计算;
②剧烈摇动锥形瓶,导致空气中的氧气参与氧化还原反应,据此分析即可.
解答 解:(1)酸性条件下过氧化氢具有氧化性,能氧化亚铁离子生成铁离子,所以试剂X为H2O2,
故答案为:H2O2;将 Fe2+氧化为 Fe3+;
(2)氧化锌为碱性氧化物,能与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去,
故答案为:降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去;
(3)因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(4)从溶液中得到固体需要蒸发浓缩、冷却结晶以及抽滤等操作,
故答案为:蒸发浓缩、冷却结晶、抽滤;
(5)此过程需要调节pH值大于11,故可以加入强碱:NaOH,由于pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-,类似与偏铝酸根,加入酸,先生成氢氧化锌沉淀,继续加入酸,沉淀溶解,
故答案为:B;先产生白色沉淀后溶解;
(6)①CuCl2溶液与KI反应的离子方程式为:2Cu2++4I-═2CuI↓+I2,且发生I2+2S2O32-═2I-+S4O62-,则可得关系式2Na2S2O3 ~2Cu2+,
则n(CuSO4•5H2O)=n(Na2S2O3)=0.100mol/L×19.40×10-3L=1.94×10-3mol,
m(CuSO4•5H2O)=1.94×10-3mol×250g/mol=0.4850g,
ω(CuSO4•5H2O)=$\frac{0.4850g}{0.5000g}$×100%=97.00%,
故答案为:97.00%;
②剧烈摇动锥形瓶,导致氧气参与氧化还原反应,从而消耗Na2S2O3标准溶液体积偏大,故测量纯度偏高,
故答案为:偏高.
点评 本题考查制备实验方案的设计,考查学生对综合实验处理能力,注意实验方案的设计原理和步骤是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,27g Al3+中含有的电子数目为13 NA | |
| B. | 22.4 L氧气中一定含有2NA个氧原子 | |
| C. | 23gNa和足量的O2完全燃烧条件下转移电子数为NA | |
| D. | 标准状况下,22.4 L乙醇(CH3CH2OH)中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y>Z | |
| B. | 电负性按X、Y、Z的顺序由弱到强 | |
| C. | 非金属性X>Y>Z | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
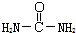 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH是还原剂 | B. | ClSO3H被还原 | ||
| C. | 反应后溶液的酸性增强 | D. | ClSO3H是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变压强不可以改变反应速率 | |
| B. | 使用催化剂能同时增大正、逆反应的速率 | |
| C. | 增大压强能增大反应速率 | |
| D. | 升高温度能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应4Al(s)+3O2(g)=2Al2O3 (s) 的△S>0 | |
| B. | 吸热反应都需要在加热条件下才能进行 | |
| C. | 同温同压下,H2 (g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 已知:①S(s)+O2(g)=SO2(g)△H=-a kJ•mol-1, ②S(g)+O2(g)=SO2(g)△H=-b kJ•mol-1,则a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com