
【题目】如图所示的8个装置属于原电池的是
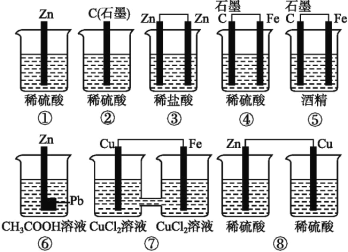
A. ①④⑤B. ②③⑥C. ④⑥⑦D. ⑥⑦⑧
【答案】C
【解析】
根据原电池中有两个活泼性不同的电极、电解质溶液、形成闭合回路,自发进行的氧化还原反应,据此分析。
①该装置只有一个电极材料,所以不能形成原电池,故错误.
②该装置只有一个电极材料,且石墨和电解质溶液不能自发的进行氧化还原反应,所以不能形成原电池,故错误.
③两电极材料相同,所以不能形成原电池,故错误.
④该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑤酒精不是电解质,铁和酒精不能自发的进行氧化还原反应,所以不能形成原电池,故错误.
⑥该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑦该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑧该装置两电极间不能构成闭合回路,所以不能形成原电池,故错误。
综上,符合条件的有④⑥⑦。
答案选C。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】CO2的捕捉、封存与再利用是实现温室气体减排的重要途径之一。请回答:
(1)二氧化碳的电子式为__________。
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为_____________ ,CO2和H2O转化为甲酸的化学方程式为____________。

(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是_______。
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率________________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是_______(填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
化学键 | H-H | H-O | C=O | C-H | C-O |
键能kJ/mol | 436 | 463 | 803 | 414 | 326 |
反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),______(填“吸收”或“放出”) 的热量为_____kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是(部分夹持装置已略去)
|
|
|
|
A证明醋酸酸性比 硼酸强 | B实验室制 氢氧化亚铁 | C实验室制氨气 | D证明碳酸氢钠热稳定 性比碳酸钠弱 |
A.AB.B…C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、M是原子序数依次增大的五种主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是__________________________。
(2)WX2的电子式是_______________________。
(3)R2X、R2Y中,稳定性较高的是____(填化学式),请从原子结构的角度解释其原因:_____。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是________(填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_____________。
(5)科研人员从矿石中分离出一种氧化物,化学式可表示为M2O3。为确定M元素的种类,进行了一系列实验,结果如下:
①M的相对原子质量介于K和Rb(铷)之间;
②0.01 mol M2O3在碱性溶液中与Zn充分反应可得到M的简单氢化物,反应完全时,被M2O3氧化的Zn为0.06 mol;
综合以上信息推断,M可能位于元素周期表第_________________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验 序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为________________________,b为________________。
②实验表明,实验III的反应速率最快,支持这一结论的实验现象为_________________________。
(2)硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O + 4S2O32- + H2O ![]() 2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
(3)工业上常用空气催化氧化法除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O),其中的物质转化过程如下图所示。
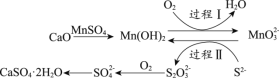
①过程I、II中,起催化剂作用的物质是_______________。
②过程II中,反应的离子方程式为_________。
③根据物质转化过程,若将10 L上清液中的S2-转化为SO42-(S2-浓度为320 mg/L),理论上共需要标准状况下的O2的体积为___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列叙述错误的是

A. T的氧化物能与碱反应
B. 元素的非金属性:Q强于W
C. W的单质共热时,能与其最高价氧化物的水化物浓溶液反应
D. 原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B. 室温下,pH=3的CH3COOH溶液与 pH=11的NaOH溶液等体积混合,溶液pH>7
C. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D. 一定条件下反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电化学的下列说法正确的是

A.工业上用电解MgCl2溶液的方法冶炼Mg
B.钢铁发生吸氧腐蚀的正极反应式为4OH﹣-4e﹣═O2↑+2H2O
C.如图14-C中发生反应的方程式为:Fe+2H+=Fe2++H2↑
D.碱性锌锰干电池放电时的正极反应为: MnO2+H2O+e-=MnOOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 乙烯与苯都能使溴水褪色,但褪色原理不同
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气 5mol
C. 溴水遇到乙醛溶液出现褪色现象,是因为发生了氧化反应
D. ![]() 与
与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com