
【题目】下列说法错误的是
A.同系物一定符合同一通式
B.同分异构体一定具有相同的最简式
C.相对分子质量相等的两种有机物必定是同分异构体
D.同分异构体间不一定有相似的化学性质
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】下列关于摩尔质量的说法正确的是
A.乙醇(C2H6O)的摩尔质量是46
B.2mol水的摩尔质量数值上是1mol水摩尔质量的2倍
C.任何物质的摩尔质量都等于它的相对分子质量
D.氧气摩尔质量是氢气摩尔质量的16倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:
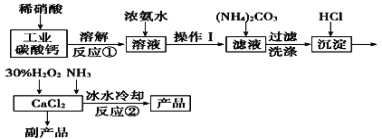
已知:CaO2·8H2O呈白色微溶于水。
(1)写出反应①中氧化还原反应的离子方程式: ______________。
(2)向反应①后的溶液中加浓氨水的目的是: __________________。
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________;②______________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴滴入浓度为c mol·L-1的Na2S2O3标准溶液至反应终点,消耗Na2S2O3溶液V mL。
已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①滴定终点的现象为____________,产品中CaO2的质量分数为_________________
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________ (填“不受影响”“偏低”或“偏高”),原因是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞中的化合物的叙述中正确的是
A. 细胞中大多数无机盐以化合物的形式存在
B. 核糖核苷酸链一定不含氢键
C. 变性后的蛋白质不能与双缩脲发生紫色反应
D. 纤维素、淀粉和糖原进行彻底水解得到的产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:

(1)在实验室中由粗盐“重结晶”的操作包括溶解、过滤、蒸发、_________(填操作方法)、洗涤等步骤;有关其中“蒸发”步骤的叙述错误的是____________。
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。

a. 得到热饱和溶液 b. 析出晶体
(3)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:__________。
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____________________________________。
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和H2O,若不补充其它原料,使一定量的MgCl2·6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则a∶b为______________(取整数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6 molH2和3 molCO充入容积为0.5 L的密闭容器中,进行反应:2H2(g) + CO(g)![]() CH3OH(g),6 s时反应达到平衡,此时容器内压强为开始时的0.6倍,则H2的平均反应速率为________________,CO的转化率为____________________。
CH3OH(g),6 s时反应达到平衡,此时容器内压强为开始时的0.6倍,则H2的平均反应速率为________________,CO的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 提取溴水中的溴单质的方法:加入酒精后,振荡、静置、分液
B. 除去CO2气体中混有的SO2的方法:通过装有饱和碳酸氢钠溶液的洗气瓶
C. 向铜和浓硫酸反应后的混合液中加水,可以判断有无铜离子生成
D. 金属钠着火可以二氧化碳气体来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有pH均为2的a盐酸、b醋酸两瓶溶液,与足量锌反应放出等体积H2所需时间的长短顺序是a____b(用“>”、“<”、“=”表示,下同);完全中和等物质的量的NaOH溶液需两种酸的体积大小顺序是a____b。
(2)已知水在25℃和95℃时,其电离平衡曲线如下图所示:
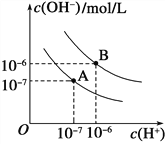
①则25℃时水的电离平衡曲线应为________(填“A”或“B”)。
②95℃时水的离子积KW=___________________。
③25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
④95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com