
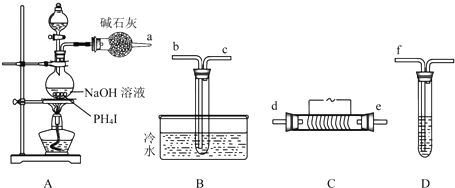
 ijУ��ѧ��ȤС��̽��SO2��FeCl3��Һ�ķ�Ӧ������װ����ͼ��ʾ���г���������ȥ����
ijУ��ѧ��ȤС��̽��SO2��FeCl3��Һ�ķ�Ӧ������װ����ͼ��ʾ���г���������ȥ�������� ��1����ȡ����ķ�Ӧװ�ã�ʵ��֮ǰӦ���װ�õ������ԣ���������β����NaOH��Һ���գ�
��2��������һ�����ʵ���Ũ�ȵ���Һ��Ҫ����������������������Ϊ���������ӣ�����ˮ����������������
��3����5mLlmo1•L-1FeCl3��Һ��ͨ��������SO2��SO2��FeCl3�ķ���������ԭ��Ӧ�������������������
��Ӧ����Һ�����ԣ��ټ���NaOHϡ��Һ���ȷ����кͷ�Ӧ��Ȼ���ٷ�Ӧ�������������������ɶ��������ž�������������������������Ϊ����������
��4��Fe��HSO3��2+��Fe3+����ΪSO42-��Fe3+����ԭΪFe2+������������ԭ���ӵ�ʧ��ƽ��
��5��SO2������ڱ�״����Ϊ672mL�����ʵ���Ϊ$\frac{0.672L}{22.4L/mol}$=0.03mol�����ݵ��ӵ�ʧ�غ㣺n��Cu����2=n��SO2����2����n��Cu2+��=0.03mol����ȫ����Cu2+��
ҪNaOH�����ʵ���Ϊ0.06mol��Cu2+Ϊ0.03mol����CuSO4Ϊ0.03mol����A�Թ���Һ�м���4mo1•L-1��NaOH��Һ30mL����n��NaOH��=0.12mol��˵����Ӧ��H2SO4������������H2SO4Ϊ0.03mol���������غ��֪5mLһ��Ũ�ȵ�ŨH2SO4�к���H2SO4��0.09mol��������c=$\frac{n}{V}$�����
��� �⣺��1����ȡ����ķ�Ӧװ�ã���ȡ֮ǰӦ���װ�õ������ԣ���������β����NaOH��Һ���գ�
�ʴ�Ϊ�������ԣ�NaOH��
��2������100mL1mol/L FeCl3��Һ������Ҫ�IJ��������У��ձ�����Ͳ������������ͷ�ιܡ�100mL������ƿ������������Ϊ���������ӣ�����ˮ����������������������ȡ���Ȼ����к�������������������������ˮ��ƽ���ƶ�ԭ��������������������Ȼ�����ˮ�⣻
�ʴ�Ϊ����ͷ�ιܡ�100mL������ƿ�������Ȼ���ˮ�⣻
��3��SO2��FeCl3�ķ���������ԭ��Ӧ�������������������ᣬ���ӷ�ӦΪ��2Fe3++SO2+2H2O=SO42-+4H++2Fe2+��
��Һ�����ԣ��ټ���NaOHϡ��Һ���ȷ����кͷ�Ӧ��Ȼ���ٷ�Ӧ�������������������ɶ��������ž�������������������������Ϊ����������
����Ϊ����ʼ������Ȼ�������ɫ������
�ʴ�Ϊ��2Fe3++SO2+2H2O=SO42-+4H++2Fe2+����ʼ������Ȼ�������ɫ������
��4��Fe��HSO3��2+��Fe3+����ΪSO42-��Fe3+����ԭΪFe2+����Ӧ���ӷ���ʽΪ��Fe3++H2O+Fe��HSO3��2+�T2Fe2++SO42-+3H+��
�ʴ�Ϊ��Fe3++H2O+Fe��HSO3��2+�T2Fe2++SO42-+3H+��
��5��SO2������ڱ�״����Ϊ672mL�����ʵ���Ϊ$\frac{0.672L}{22.4L/mol}$=0.03mol�����ݵ��ӵ�ʧ�غ㣺n��Cu����2=n��SO2����2����n��Cu2+��=0.03mol����ȫ����Cu2+��
ҪNaOH�����ʵ���Ϊ0.06mol��Cu2+Ϊ0.03mol����CuSO4Ϊ0.03mol����A�Թ���Һ�м���4mo1•L-1��NaOH��Һ30mL����n��NaOH��=0.12mol��˵����Ӧ��H2SO4������������H2SO4Ϊ0.03mol���������غ��֪5mLһ��Ũ�ȵ�ŨH2SO4�к���H2SO4��0.09mol�������ʵ���Ũ��Ϊc=$\frac{n}{V}$=$\frac{0.09mol}{0.005L}$=18 mo1•L-1��
�ʴ�Ϊ��18 mo1•L-1��
���� ����ΪSO2������̽��ʵ�飬�漰װ�������Եļ��飬��Һ���ơ����ʵ����ʡ�������ԭ��Ӧԭ�������ã���Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
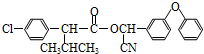 ��
��
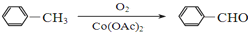
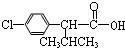 +
+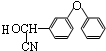 $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$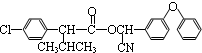 +H2O��
+H2O��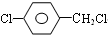 +3NaOH$��_{��}^{H_{2}O}$2NaCl+H2O+
+3NaOH$��_{��}^{H_{2}O}$2NaCl+H2O+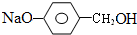 ��
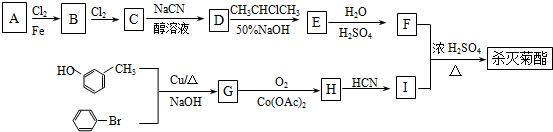
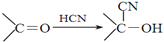
��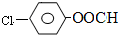 �ṹ������ϴ�������F����8�֣�
�ṹ������ϴ�������F����8�֣�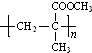 ���úϳ�·������ͼ��ʾ����ע����Ӧ��������
���úϳ�·������ͼ��ʾ����ע����Ӧ���������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ����� | ʵ��Ŀ�� | |
| A | ����ʪ��NH3ͨ��ʢ����ˮCaCl2�ĸ���� | ��ȥNH3�е�ˮ���� |
| B | ������ϡ���ᷴӦ�����Һ�е���KSCN��Һ | ��֤��Һ���Ƿ���Fe3+ |
| C | ������ָʾ�����ñ�NaOH��Һ�ζ���������ɫ | �����������ʵ���Ũ�� |
| D | ��2ml0.2mol/L��AgNO3��Һ���Ⱥ�μ�0.2mol/L ��NaCl��Һ��KBr��Һ��5�� | ȷ��AgCl��AgBr��Kap����Դ�С |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.0 g D218O�к��е�������ΪNA | |
| B�� | ��״���£�22.4 L NH3���Ӻ��е��ӻ������Ϊ4 NA | |
| C�� | 78 g Na2O2�������������������Ӹ�����Ϊ2 NA | |
| D�� | 1 mol Fe��ȫ����һ������������Һ�У�ת�Ƶĵ�����һ����3 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �屽��ˮ | B�� | ��������Ҵ� | C�� | ���ͺ�ˮ | D�� | �屽�ͱ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| X | Y | |
| Z | W |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
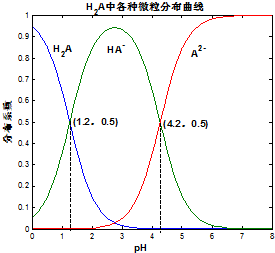 ������ 0.1mol/L��H2A��Һ��H2A��HA-��A2- ��������ռ���ʵ����������ֲ�ϵ������pH�仯�Ĺ�ϵ��ͼ��ʾ�����б�������ȷ���ǣ�������
������ 0.1mol/L��H2A��Һ��H2A��HA-��A2- ��������ռ���ʵ����������ֲ�ϵ������pH�仯�Ĺ�ϵ��ͼ��ʾ�����б�������ȷ���ǣ�������| A�� | H2A?2H++A2- K=10-5.4 | |
| B�� | �� 0.1mol/L NaHA��Һ�У�������Ũ�ȴ�С��ϵΪ��c��Na+����c��HA-����c��H+����c��A2-����c��OH-�� | |
| C�� | ��֪25��ʱHF�� Ka=10-3.45��������H2A����Һ��������NaF��Һ�У������ķ�ӦΪ��H2A+F-�THF+HA- | |
| D�� | �������ʵ�����NaHA��Na2A����ˮ�У�������ҺpHǡ��Ϊ4.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����12.5g����NaOHʱ����������������ϣ�NaOH���������� | |
| B�� | ѡ�õ�����ƿ������������ˮ | |
| C�� | ����ʱ���ӿ̶��� | |
| D�� | ����ҡ�Ⱥ�Һ���½����ּ�ˮ���̶��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com