
【题目】分析下列各项结构的规律,按此规律排布第10项的分子式应为( )

A. C198H146 B. C196H155 C. C196H146 D. C198H155
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有关右图装置的叙述中,正确的是( )
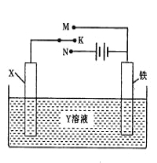
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小
D.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动[来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按原子序数递增,下列有关碱金属元素性质的递变规律正确的是( )
A. 失电子能力逐渐增强
B. 化合价逐渐升高
C. 金属性逐渐减弱
D. 最高价氧化物对应的水化物碱性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() (R、R′、R″是各种烃基)如上式烯烃的氧化反应,双键被高锰酸钾酸性溶液氧化而断裂,在断键两端的碳原子都被氧化成为羧基或酮羰基.由氧化所得的产物,可以推测反应物烯烃的结构.今有A、B、C三个含有双键的化合物,它们被上述溶液氧化:
(R、R′、R″是各种烃基)如上式烯烃的氧化反应,双键被高锰酸钾酸性溶液氧化而断裂,在断键两端的碳原子都被氧化成为羧基或酮羰基.由氧化所得的产物,可以推测反应物烯烃的结构.今有A、B、C三个含有双键的化合物,它们被上述溶液氧化:
1molA(分子式C8H16),氧化得到2mol酮D.
1molB(分子式C8H14),氧化得到2mol酮E和1mol二元羧酸.
1molC(分子式C8H14),氧化只得到一种产物,它是一种没有支链的二元羧酸.
请据此推断B、C、D、E的结构简式为:B 、C 、D 、E .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,以它为原料还可以合成很多的化工产品。现有以下转化:

(1)聚乙烯的结构简式为 ;
(2)写出以下反应的化学方程式和反应类型:
② ,反应类型是
③ ,反应类型是
(3)实验室用如图装置制备乙酸乙酯:试管中碎瓷片的作用是 ;导管a的作用是导气和 ;试管b内饱和Na2CO3溶液的作用一方面是除去乙酸乙酯中混有的乙酸和乙醇,另一方面是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种典型的强氧化剂。请回答下列问题:
(1)实验室中可用已知浓度的酸性高锰酸钾溶液滴定含Fe2+的溶液,从而测定溶液中Fe2+的浓度,离子反应方程式如下,请在空格内填上缺少的反应物,并配平:
_______-Fe2++_______MnO![]() +_______
+_______![]() ===_______Fe3++_______Mn2++_______H2O
===_______Fe3++_______Mn2++_______H2O
(2)在稀硫酸中,MnO![]() 和H2O2也能发生氧化还原反应:
和H2O2也能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
①写出该氧化还原反应的化学方程式:__________________。
反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应快速放出气体。其可能的原因是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+
B.40mLlmol/LCH3COONa溶液与20mLlmol/LHCl溶液混合后溶液呈酸性,所得溶液中:c (CH3COO-) > c(Cl-)>c(H+)>c(OH-)
C.常温下,Cd(0H)2和Co(0H)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍
己知:Ksp[Cd(0H)2]=7.2×10-15,Ksp[Co(0H)2]=1.8×10-15
D.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7): c(Na+)=c(CH3COO-)> c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com