
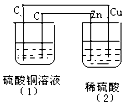
 如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )
如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )| A. | 相同条件下,两容器产生的气体体积相同 | |
| B. | (1)、(2)溶液的pH值均减小 | |
| C. | (1)中阳极电极反应方程式为:4OH--4e-═2H2O+O2↑ | |
| D. | (2)中正极反应为Zn-2e-═Zn2+ |
分析 (2)为原电池,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,(1)为电解池,阳极反应为4OH--4e-=2H2O+O2↑,阴极反应为Cu2++2e-=Cu,为电解硫酸铜的反应,以此解答该题.
解答 解:A.相同条件下,如转移0.02mol电子,则(2)正极发生2H++2e-=H2↑,生成0.01molH2,(1)阳极发生4OH--4e-=2H2O+O2↑,生成0.005molO2,故A错误;
B.(1)中消耗氢离子,pH增大,(2)电解生成氢离子,溶液的pH值减小,故B错误;
C.(1)为电解池,阳极反应为4OH--4e-=2H2O+O2↑,故C正确;
D.锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,故D错误.
故选C.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合考查,注意根据电极方程式的书写和电池种类的判断,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶 液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | CO2 | |
| (2)AlCl3溶液 | 过量NH3 | |
| (3)含少量NaOH的NaAlO2 | 过量CO2 | |
| (4)含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | |
| (5)MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | |
| (6)NaOH溶液 | 逐滴加AlCl3至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CH4的分子数之比为1:1 | B. | NH3、CH4两种气体的密度之比为a:b | ||
| C. | NH3、CH4的摩尔质量之比为17:16 | D. | NH3、CH4的物质的量之比为a:b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com