
【题目】蛋白质、油脂、糖类都是人体必需的营养物质。
(1)蛋白质完全水解后生成_____ (写名称),通常情况下,蛋白质遇饱和硫酸钠溶液会发生_____(填“盐析”或“变性”).
(2)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和_______(填名称)。
(3)淀粉遇I2显__色,淀粉在淀粉酶的作用下最终水解为葡萄糖,其水解的化学反应方程式为__,可检验淀粉发生水解的试剂是_____ ( 填字母)。
a.碘水 b.碘化钾溶液 c.新制的银氨溶液
(4)葡萄糖在人体中发生缓慢氧化,放出热量。已知0.1 mol葡萄糖完全氧化能释放出280.3kJ的热量,请写出葡萄糖供能的热化学方程式:___________.
【答案】氨基酸 盐析 甘油(或丙三醇) 蓝 (C6H10O5)n+nH2O![]() nC6H12O6 c C6H12O6(s)+6O2(g) →6CO2(g)+6H2O(l) ΔH=-2803kJ·mol-1
nC6H12O6 c C6H12O6(s)+6O2(g) →6CO2(g)+6H2O(l) ΔH=-2803kJ·mol-1
【解析】
(1)蛋白质完全水解生成氨基酸;蛋白质遇饱和硫酸钠溶液会发生盐析;
(2)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和甘油(或丙三醇);
(3)淀粉遇碘变蓝;淀粉在淀粉酶的作用下水解成葡萄糖的化学方程式为(C6H10O5)n+nH2O![]() nC6H12O6;只要检验到葡萄糖即可说明淀粉发生水解,葡萄糖含有醛基,可以用新制的银氨溶液检验,可以发生银镜反应,所以选c;
nC6H12O6;只要检验到葡萄糖即可说明淀粉发生水解,葡萄糖含有醛基,可以用新制的银氨溶液检验,可以发生银镜反应,所以选c;
(4)0.1 mol葡萄糖完全氧化能释放出280.3kJ的热量,则1mol葡萄糖完全氧化释放2803kJ能量,热化学方程式为C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) ΔH=-2803kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48L(标准状况),向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全。则下列有关叙述中不正确的是
A.开始加入合金的物质的量之和为0.3mol
B.生成沉淀的质量比原合金的质量增加10.2g
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.反应中被还原和未被还原的硝酸物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、E、H是生活中常见的有机物,H常用于食品包装,A的产量是石油化工发展水平的标志。根据如图转化关系回答问题:
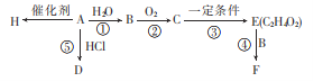
(1)写出A和F中官能团的名称:A___,F___。
(2)反应①、④的反应类型分别为___、___。
(3)写出D和E的结构简式:D___、E___。
(4)请写出下列反应的化学方程式:
I.写出反应②在催化剂存在的条件下并加热的化学方程式:___。
II.A→H的化学方程式:___。
(5)H是一种常见的高分子材料,由这种材料造成的环境问题是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
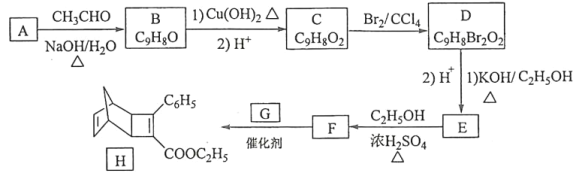
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:
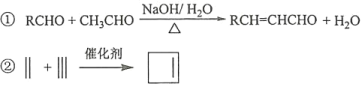
回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2–丁炔为原料制备化合物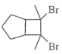 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Na+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。
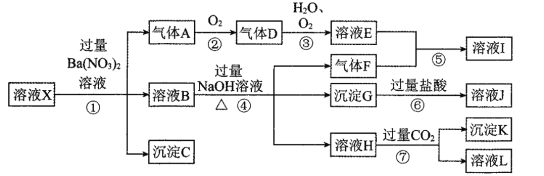
请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有______。
(2)产生气体A的离子方程式为____________。
(3)在实验室中收集气体A,可选择如图装置中的______。

(4)写出④反应中生成溶液H的离子方程式____________。
(5)对不能确定是否存在的离子,请简述检测实验方案__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的反应:3H2 (g)+N2 (g) ![]() NH3 (g),达到限度的标志是( )
NH3 (g),达到限度的标志是( )
A.H2、N2、NH3的分子个数之比为3:1:2B.N2的正反应速率和逆反应速率相等
C.反应已经停止D.单位时间内生成3mol H2,同时生成1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是_________mol;
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是____________,又变为棕黄色的原因是用离子方程式解释____________;
(3)在100mL FeBr2溶液中通入标况下2.24LCl2,溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是
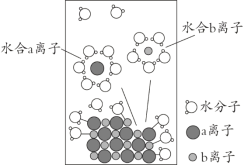
A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)是第VA族元素,其单质主要用于制造合金、半导体。三氧化二锑俗称锑白,是白色粉末,不溶于水,是一种两性氧化物,主要用于白色颜料、油漆和塑料、石油化工等。某工厂用羽毛矿(主要成分为Pb4FeSb6S14)制取锑白的工艺流程如图所示:

(1)Pb4FeSb6S14中的锑元素只显一种化合价,则其化合价是______。X是一种固体单质,其成分是___(填化学式)。
(2)氯化浸出中,除铅与X外,被氧化的元素反应后均显高价,写出相应的化学方程式:______________。操作1为加水稀释,写出生成SbOCl的离子方程式:___________。
(3)试剂1通常选用氨水而不是NaOH溶液,最可能的原因是_______。操作2的内容是_________、干燥。
(4)在强碱性条件下电解Na3SbS3溶液(原理如图)可得到单质锑。
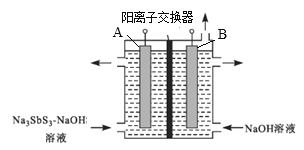
写出阴极的电极反应式:_______,B电极应接电源的______极,当有2 mol Sb生成时,通过阳离子交换膜的离子数为_________(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com