
| A. | 用KI溶液除去FeCl2溶液中的Fe3+ | B. | 用饱和NaHCO3溶液除去Cl2中的HC1 | ||
| C. | 用金属钠鉴别1一丁醇和2一丁醇 | D. | 用溴水鉴别苯和己烯 |
分析 A.加入碘化钾后引进了杂质钾离子,违反了除杂原则;
B.氯气溶于水生成的氯化氢能够与碳酸氢钠溶液反应;
C.1-丁醇和2-丁醇都与金属钠反应;
D.苯与溴水分层,与己烯发生加成反应而褪色.
解答 解:A.不能用KI溶液除去FeCl2溶液中的Fe3+,否则会引进杂质钾离子,可用过量铁粉,故A错误;
B.NaHCO3溶液与Cl2反应,不能用饱和NaHCO3溶液除去Cl2中的HC1,可用饱和食盐水,故B错误;
C.金属Na与1-丁醇、2-丁醇都反应,无法用钠鉴别二者,故C错误;
D.溴水中加入苯后混合液分层,己烯中加入溴水发生加成反应导致溴水褪色,两溶液与溴水混合后现象不同,可用溴水鉴别苯和己烯,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度不大,侧重考查物质分离与提纯、鉴别方法,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析能力及化学实验能力.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:填空题
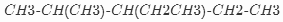 的名称是2-甲基-3-乙基戊烷.
的名称是2-甲基-3-乙基戊烷. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
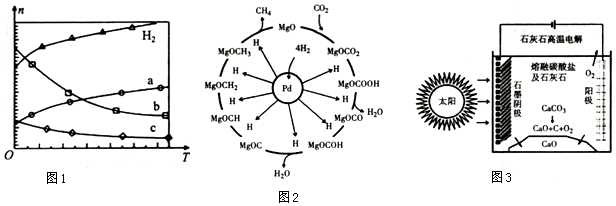
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
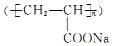 和苯甲酸异丙酯流程如下(部分条件已经略去):
和苯甲酸异丙酯流程如下(部分条件已经略去):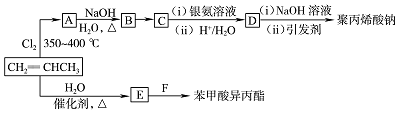
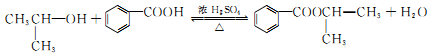 .
.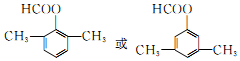 .
.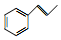 和F为原料(无机试剂任选),设计制备有机物
和F为原料(无机试剂任选),设计制备有机物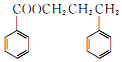 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结 论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 2mL10%的CuSO4溶液中滴加2%的NaOH溶液4~6滴制得新制氢氧化铜,再滴加几滴葡萄糖溶液,加热 | 检验葡萄糖中含有醛基 |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)<Ksp(AgI) |
| D | 将Al2(SO4)3溶液蒸干、灼烧至恒重 | 最终剩余固体是Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量H2S:H+、Fe2+、Al3+、SO42- | |
| B. | 通入过量氨气:NH4+、A1O2-、OH-、SO42- | |
| C. | 加入过量NaC1O溶液:Fe3+、Na+、ClO-、SO42- | |
| D. | 加入过量NaOH溶液:Na+、A1O2-、OH-、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
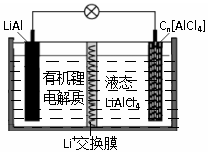 某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )| A. | 充电时,Cn为阳极,电极反应为:Cn+AlCl4--e-═Cn[AlCl4] | |
| B. | 放电时,当电路中通过0.1mol电子时,有0.1molLi+通过交换膜向LiAl极移动 | |
| C. | LiAl具有强氧化性,放电时作负极材料 | |
| D. | 电池中可能发生副反应:2Al+6H2O═2Al(OH)3+3H2↑,故该电池存在安全隐患 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com