
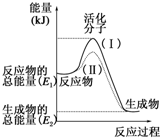
 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.分析 (1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热,故答案为:放热;
(2)在反应H2+I2?2HI中,断裂1molH-H键,1molI-I键共吸收的能量为:1×436kJ+151kJ=587kJ,生成2molHI,共形成2molH-I键,放出的能量为:2×299kJ=598kJ,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:598kJ-587kJ=11kJ,故答案为:放出;11;
(3)①物质燃烧属于放热反应; ②炸药爆炸属于放热反应; ③酸碱中和反应属于放热反应; ④二氧化碳通过炽热的碳虽然属于化合反应,但为吸热反应;
⑤食物因氧化而腐败属于放热反应; ⑥Ba(OH)2•8H2O与NH4Cl反应为吸热反应 ⑦铁粉与稀盐酸反应属于放热反应;
所以放热反应有:①②③⑤⑦;吸热反应有:④⑥,
故答案为:①②③⑤⑦;④⑥.
点评 本题考查焓变的求算,△H=生成物能量-反应物能量=反应物键能和-生成物键能和,以及化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


科目:高中化学 来源: 题型:选择题
| A. | X可能是第二周期非金属元素 | B. | Y可能与X同主族 | ||
| C. | X可能是第三周期金属元素 | D. | Y一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
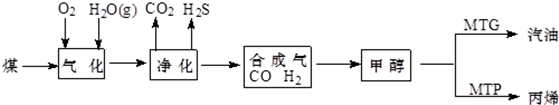
 .
.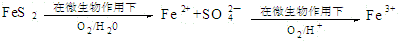
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | Na2S04溶液 | AgN03溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积/滴 | 浓度/(mol•L-1) | ||
| ① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-1) | 稀释后Ag+浓度/(mol•L-1) | 混合液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.0l | 0.12 |
| ④ | 0.001 |
| 编号 | AgNO3溶液 浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
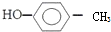
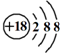
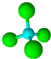
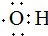
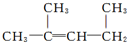 的名称:1,3-二甲基-2丁烯( )
的名称:1,3-二甲基-2丁烯( )| A. | ⑤ | B. | ④⑤ | C. | ③⑦ | D. | ②⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL | B. | 72mL | C. | 78mL | D. | 100mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com