
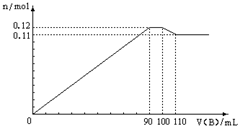
 向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:分析 图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀完全;
图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等;
图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解;
图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共1.1mol,据此对各选项进行解答.
解答 解:第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀完全;第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等;第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解;第四段曲线中,沉淀为Fe(OH)3、BaSO4共1.1mol,
(1)根据分析可知,加入110mLB溶液时,剩余的沉淀为Fe(OH)3、BaSO4的混合物,根据质量守恒可知溶质为NaCl、NaAlO2、Na2SO4,
故答案为:Fe(OH)3、BaSO4;NaCl、NaAlO2、Na2SO4;
(2)加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了0.1molAl(OH)3,消耗了10mLB溶液,故c(NaOH)=$\frac{0.1mol}{0.01L}$=10mol/L;加入的90mLB溶液中含有氢氧根离子的物质的量为:10mol/L×0.09mol=0.9mol,生成氢氧化铝、氢氧化铁沉淀的物质的量为:0.9mol×$\frac{1}{3}$=0.3mol,生成硫酸钡沉淀的物质的量为:1.2mol-0.3mol=0.9mol,故c(Na2SO4)=$\frac{0.9mol}{0.09L}$=10mol/L,所以B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1,
故答案为:1:1;
(3)90-110mLB溶液时氢氧化铝完全溶解,消耗了20mL氢氧化钠溶液,参加反应的氢氧根离子的物质的量为:10mol/L×0.2L=0.2mol,根据反应Al(OH)3+OH-=AlO2-+2H2O可知,原溶液中铝离子的总物质的量为0.2mol,则氯化铝的物质的量为0.2mol,其浓度为:$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:2mol/L.
点评 本题考查混合物反应的计算,题目难度中等,根据图象正确判断各阶段的离子反应为解答关键,然后结合各阶段的各种物质的量进行计算,试题侧重考查学生的分析、推理能力.


科目:高中化学 来源: 题型:填空题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| B. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O | |
| D. | 氢氧化钡溶液中加过量小苏打:Ba2++OH-+HCO3-=BaCO3↓+H2O. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
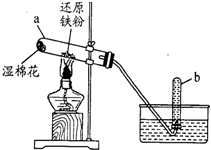
| A. | 甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰 | |
| B. | 乙同学认为试管a中生成的黑色固体可能为四氧化三铁 | |
| C. | 丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应 | |
| D. | 丁同学认为可用盐酸和KSCN溶液来验证产物中的三价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有同质量、不同体积的N2O和CO2 | B. | 具有同温度、同体积的CO和N2 | ||
| C. | 具有同体积、同密度的SO2和NO2 | D. | 具有同密度、不同质量的O2和O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溴水、铁粉和苯混合加热即可制得溴苯 | |
| B. | 除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,再用分液漏斗分液 | |
| C. | 用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在反应混合液中 | |
| D. | 制取硝基苯时,应先向试管中加入浓H2SO4 2 mL,再加入1.5 mL浓HNO3,再滴入苯约1 mL,然后放在水浴中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{214}$Pu位于周期表中第六周期 | |
| B. | ${\;}_{53}^{131}$ I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com