
 填空
填空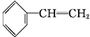 +Br2→
+Br2→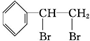 .
.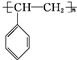 .A与氢气完全加成后的一氯代物共有6种.
.A与氢气完全加成后的一氯代物共有6种.分析 1molA中n(C)=$\frac{104g×92.3%}{12g/mol}$=8mol,n(H)=$\frac{104g×(1-92.3%)}{1g/mol}$=8,可知分子式为C8H8,A与溴的四氯化碳溶液反应,说明含有碳碳双键,应为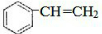 ,可发生加成、加聚反应,与氢气完全发生加成反应生成
,可发生加成、加聚反应,与氢气完全发生加成反应生成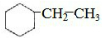 ,乙酸乙酯在浓硫酸作用下加热生成乙酸乙酯,吸收乙酸乙酯注意防止倒吸,以此解答该题.
,乙酸乙酯在浓硫酸作用下加热生成乙酸乙酯,吸收乙酸乙酯注意防止倒吸,以此解答该题.
解答 解:(1)1molA中n(C)=$\frac{104g×92.3%}{12g/mol}$=8mol,n(H)=$\frac{104g×(1-92.3%)}{1g/mol}$=8,则分子式为C8H8,该物质含有苯环,能与溴发生反应,说明A应为苯乙烯,结构为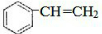 ,与溴发生加成反应生成
,与溴发生加成反应生成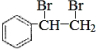 ,则反应的方程式为
,则反应的方程式为 +Br2→
+Br2→ ,
,
故答案为: +Br2→
+Br2→ ;
;
(2)含有C=C,可发生加聚反应生成聚苯乙烯,即 ,与氢气完全发生加成反应生成
,与氢气完全发生加成反应生成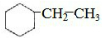 ,分子中含有6种不同的H原子,如图:
,分子中含有6种不同的H原子,如图: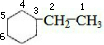 ,一氯代物有6种,
,一氯代物有6种,
故答案为: ;6;
;6;
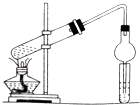
(3)乙酸乙酯在浓硫酸作用下加热生成乙酸乙酯,反应的方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,因乙酸、乙醇易溶于水,则装置中干燥管可起到防止倒吸的作用,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;饱和碳酸钠溶液;防止倒吸.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意根据元素的含量和相对分子质量推断A为解答该题的关键,学习中注意有机物官能团的性质.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4•7H2O溶解在90 g水中 | |
| C. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并搅拌均匀 | |
| D. | 为减小溶液配制误差,容量瓶必须洗净并烘干后才能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式分别为C2H4和C4H8的两种有机物一定是同系物 | |
| B. | 同一种分子式可能代表不止一种物质 | |
| C. | 苯的产量是石化工业发展水平的标志 | |
| D. | 烷烃的通式是:CnH2n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大豆 | B. | 甜菜 | C. | 茶叶 | D. | 西瓜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L0.6mol•L-1的食盐水中含氯化钠0.6mol | |
| B. | 0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 标准状况下,44.8L氯化氢气体溶于1L水中所得溶液的物质的量浓度为2mol•L-1 | |
| D. | 20g氢氧化钠溶于水配成物质的量浓度为1mol•L-1的溶液,可得溶液1L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 虽然药物能治病,但大部份药物有毒副作用 | |
| B. | 使用青霉素时,不用进行试验直接静脉注射 | |
| C. | 长期大量使用阿司匹林可预防疾病,没有副作用 | |
| D. | 对于标记“OTC”的药物,必需在医生指导下使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com