
根据实验目的判断下列实验操作或装置正确的是
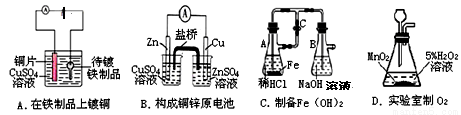
科目:高中化学 来源:2013-2014四川省资阳市高一下学期期末考试化学试卷(解析版) 题型:选择题
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.120mLB.60 mLC.40 mLD.30 mL
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
下列各溶液中,相关微粒物质的量浓度关系不正确的是
A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-)
B.0.1 mol·L-1 NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1
C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列化学实验叙述正确的是
A. 实验室从海带中提取单质碘的步骤:取样→灼烧→溶解→过滤→萃取
B. 将饱和FeCl3溶液滴入沸水,继续加热煮沸至出现红褐色沉淀即得Fe(OH)3胶体
C. 要检验滴有稀硫酸的蔗糖溶液是否水解,可加入银氨溶液,再水浴加热
D. 钠的焰色反应实验需要用酒精灯、铂丝、氯化钠溶液和稀盐酸
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省眉山市高三第二次诊断性考试理综化学试卷(解析版) 题型:简答题
(16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。
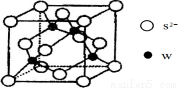
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:实验题
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。
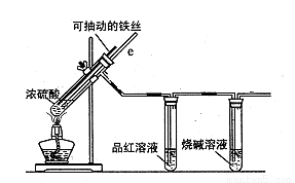
(1)写出铁与浓硫酸反应的化学方程式 ;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)品红溶液的作用是 。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
可用下图所示装置制取(必要时可加热)、净化、收集的气体是
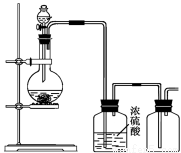
A.铜与稀硝酸反应制一氧化氮
B.氯化铵与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.亚硫酸钠固体与硫酸反应制二氧化硫
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
下列有关环境保护与绿色化学的叙述不正确的是
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.水华、赤潮等水体污染主要是由含氮、磷的污水任意排放造成的
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高二下学期期中联考化学试卷(解析版) 题型:填空题
(I)保护环境已成为当前和未来的一项全球性课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
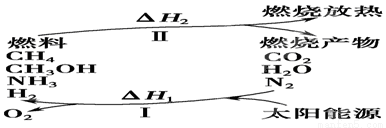
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)上述转化过程中,ΔH1和ΔH2的关系是________。
(3)断裂1 mol化学键所需的能量见下表:
共价键 | H—N | H—O | N≡N | O=O |
断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_______________________。
(II)在一试管中加入0.01mol/L的KMnO4酸性溶液和0.1mol/LH2C2O4溶液,在恒温下发生如下反应:
2KMnO4+5 H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O。5分钟后测得Mn2+的浓度为0.004mol/L;
(4)试计算0—5分钟内,υ(H2C2O4)=____________。
(5)如果反应从开始进行一段时间后,速率—时间图像如图: 。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com