
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
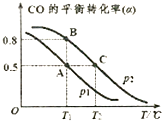 (2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.c(N
| ||
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1×10-13mol/L | B.0.02mol/L |
| C.1×10-7mol/L | D.1×10-12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)某学生在25℃下用纯水制备了一份氢氧化镁饱和溶液,测得溶液的pH为10.5。
1.用上述测定数据计算氢氧化镁的溶解度(用mol/L和g/100mL两种单位表示)
2.计算氢氧化镁的溶度积。
3.计算25℃下在0.010mol/L NaOH中氢氧化镁的溶解度。
4.25℃下将10g Mg(OH)2和100mL 0.100mol/L HCl的混合物用磁子长时间搅拌,计算该体系达平衡时液相的pH。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省安阳一中分校高一(下)期末化学试卷(理科)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com