
【题目】工业上从海水中提取镁的流程如图所示,据此回答下列问题:
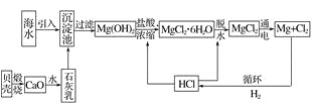
(1)在沉淀池中加入石灰乳的作用是__。
(2)生产过程中,过滤得到的Mg(OH)2沉淀中混有少量Ca(OH)2,实验室中除去Mg(OH)2沉淀中混有的少量Ca(OH)2的方法:先将沉淀加入到盛有__溶液的烧杯中,充分搅拌后经___(填操作方法,下同)、__、__,即可得到纯净的Mg(OH)2。
(3)下列关于题述流程中海水提镁的说法不正确的是__(填字母)。
A.此法的优点之一是原料来源丰富
B.副产品可用于氯碱工业
C.电解时会产生氯气
D.该流程中涉及的化学反应有分解反应、化合反应和置换反应
(4)电解无水氯化镁(熔融态)所得的镁蒸气在特定环境中冷却后可得到固体金属镁,则下列物质可用作镁蒸气的冷却剂的是___(填序号)。
A.H2 B.N2 C.空气 D.O2 E.水蒸气
(5)在SO2中点燃的镁条像在CO2中那样继续燃烧,但反应较镁和CO2反应更为剧烈,反应结束后,在盛有SO2的广口瓶中可能存在的物质是___(写化学式),反应的化学方程式为__、__。
【答案】使Mg2+转化为Mg(OH)2沉淀 MgCl2(或氯化镁) 过滤 洗涤 干燥 D A MgO、MgS 2Mg+SO2![]() 2MgO+S Mg+S
2MgO+S Mg+S![]() MgS
MgS
【解析】
从海水中提取镁的基本原理:将贝壳煅烧得到生石灰,并将生石灰制成石灰乳;将石灰乳加入沉淀池中使Mg2+转化为Mg(OH)2沉淀;在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液;在一定条件下蒸发MgCl2溶液得到无水MgCl2;电解熔融氯化镁可得到Mg。要除去Mg(OH)2沉淀中混有的少量Ca(OH)2,可加入过量MgCl2溶液,使Ca(OH)2中的OH-完全转化为Mg(OH)2沉淀,经过滤、洗涤、干燥,即可得到纯净的Mg(OH)2沉淀。镁的还原性较强,能与N2、空气中的O2、水蒸气反应,故冷却镁蒸气只能选用不与镁反应的H2。
联想镁和CO2的反应,镁能够在CO2中剧烈燃烧生成氧化镁和碳,镁置换出CO2中的C。然后将此反应迁移到镁和SO2的反应中来,镁置换出SO2中的S,生成的S还能与镁反应生成MgS,这就不同于镁和CO2的反应。
(1)在沉淀池中加入石灰乳的作用是使Mg2+转化为Mg(OH)2沉淀。故答案为:使Mg2+转化为Mg(OH)2沉淀;
(2)实验室中除去Mg(OH)2沉淀中混有的少量Ca(OH)2的方法:先将沉淀加入到盛有MgCl2(或氯化镁)溶液的烧杯中,充分搅拌后经过滤、洗涤、干燥,即可得到纯净的Mg(OH)2。故答案为:MgCl2(或氯化镁);过滤、洗涤、干燥;
(3)关于题述流程中海水提镁的说法:
A.利用海水、贝壳,原料来源丰富,故A正确;
B.副产品氯气可用于氯碱工业,故B正确;
C.电解氯化镁时会产生镁和氯气,故C正确;
D.该流程中涉及的化学反应有分解反应如电解氯化镁、化合反应如氧化钙和水反应,没有置换反应,故D错误;
故选D。
(4)电解无水氯化镁(熔融态)所得的镁蒸气在特定环境中冷却后可得到固体金属镁,可用作镁蒸气的冷却剂的是氢气,N2、空气、O2 、水蒸气均能将镁氧化。
故选A。
(5)镁置换出SO2中的S,生成的S还能与镁反应生成MgS,反应结束后,在盛有SO2的广口瓶中可能存在的物质是MgO、MgS,反应的化学方程式为2Mg+SO2![]() 2MgO+S 、Mg+S
2MgO+S 、Mg+S![]() MgS。
MgS。
故答案为:MgO、MgS;2Mg+SO2![]() 2MgO+S 、 Mg+S
2MgO+S 、 Mg+S![]() MgS。
MgS。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:

已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
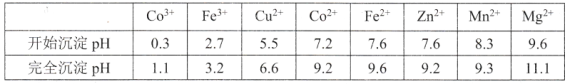
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3的作用是_________,相关的离子方程式为__________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为__________________(写化学式)。滤液3经过多次萃取与反萃取制备CoCl2晶体
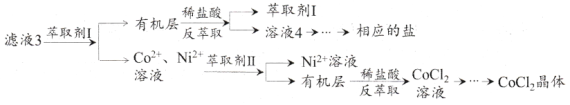
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是___________________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用●标注。下列说法正确的是( )
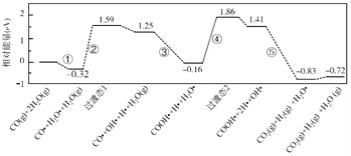
A.水煤气变换反应的△H<0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H﹣H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
选项 | 用途 | 性质 |
A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
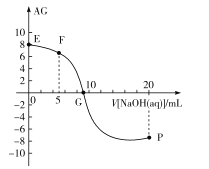
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
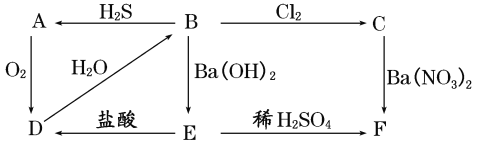
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | Ka=1.75×10-5 |
柠檬酸(H3C6H5O7) | Ka1=7.4×10-4 Ka2=1.73×10-5 Ka3=4.0×10-7 |
NH3·H2O | Kb=1.75×10-5 |
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.![]()
B.c(H+)
C.c(OH-)·c(H+)
D.![]()
E.![]()
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:
①N2(g)+O2(g)=2NO(g) △H1
②2NH3(g)![]() N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=_____(用△H1,△H2,△H3表示)。
(2)在2L密闭绝热容器中,投入4molN2和6molH2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
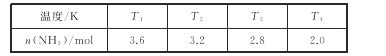
①下列能说明该反应已达到平衡状态的是_____。
A.3v正(H2)=2v逆(NH3)
B.容器内气体压强不变
C.混合气体的密度不变
D.混合气的温度保持不变
②温度T1_____(填“>”<”或“=”)T3。
③在T4温度下,达到平衡时N2的转化率为_____。
(3)N2O4为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)=2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=_____kPa·s-1。
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图。阴极的电极反应式为_____,电解槽中的隔膜为_____(填“阳”或“阴”)离子交换膜。每处理1molNO,电路中通过电子的物质的量为_____。
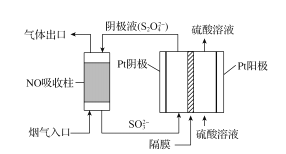
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com