
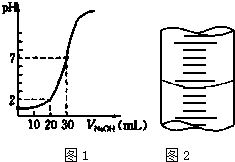
 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:分析 (1)装液时,调节滴定管尖嘴使之充满溶液,使管内无气泡;
(2)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(3)根据待测液中加入酚酞,溶液为无色,反应完全后氢氧化钠过量,溶液变成红色判断达到终点现象;
(4)(5)根据图象知,当V(NaOH)=30mL时,混合溶液呈中性,说明n(HCl)=n(NaOH),盐酸的体积是10mL,氢氧化钠的体积是30mL,则c(HCl)=3c(NaOH),当氢氧化钠溶液体积为20mL时,混合溶液的pH=2,结合c(H+)=$\frac{c(HCl)×V(HCl)-c(NaOH)×V(NaOH)}{V(HCl)+V(NaOH)}$计算酸、碱浓度;
(6)根据滴定管的结构与测量原理来解答;
(7)根据少滴了1滴H2SO4,溶液呈碱性,抓住过量的OH-求出c(OH-),然后根据水的离子积常数求出c(H+).
解答 解:(1)装液时,把盛有NaOH溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
故答案为:调节滴定管尖嘴使之充满溶液;
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$可知,测定c(待测)偏低;
故选:偏低;
(3)盐酸中加入酚酞,溶液显示无色,盐酸反应完全后,加入氢氧化钠溶液后,溶液显示红色,所以滴定终点为最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去;
故答案为:最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去;
(4)(5)根据图象知,当V(NaOH)=30mL时,混合溶液呈中性,说明n(HCl)=n(NaOH),盐酸的体积是10mL,氢氧化钠的体积是30mL,则c(HCl)=3c(NaOH),当氢氧化钠溶液体积为20mL时,混合溶液的pH=2,则c(H+)=$\frac{c(HCl)×V(HCl)-c(NaOH)×V(NaOH)}{V(HCl)+V(NaOH)}$=$\frac{3c(NaOH)×0.01L-c(NaOH)×0.02L}{0.01L+0.02L}$=0.01mol/L,所以c(NaOH)=0.03mol/L,c(HCl)=3c(NaOH)=0.09mol/L,
故答案为:0.09;0.03;
(6)由于滴定管下端有一段没有刻度,滴定管中液体的体积一定大于(25-a)mL;
故答案为:D;
(7)少加1滴H2SO4,过量的氢氧根离子的物质的量为0.01mol•L-1×2×0.05×10-3L=1×10-6mol,溶液中c(OH-)=$\frac{1×1{0}^{-6}mol}{0.1L}$=10-5 mol•L-1,则c(H+)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol•L-1=10-9mol•L-1,此时溶液的pH为9,故答案为:9.
点评 本题考查了酸碱中和滴定操作、误差分析、溶液中氢离子浓度的计算,根据溶液体积确定酸碱浓度关系即可完成,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2L乙醇蒸气含共价键数目为4NA | |
| C. | 1molK与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L0.2mol•L-1NH4ClO4溶液中含NH4+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有较强的还原性,故不能用浓硫酸干燥 | |
| B. | 苯、溴水、铁粉混合可制成溴苯 | |
| C. | 苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应 | |
| D. | FeCl3溶液可以腐蚀线路板上的Cu,不能说明Cu的金属活动性大于Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一句 | B. | 第二句 | C. | 第三句 | D. | 第四句 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
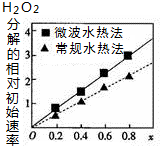 已知CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性,通常由两种不同方法制得.如图为二种方法制得的催化剂,在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线图.下列说法错误的是( )
已知CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性,通常由两种不同方法制得.如图为二种方法制得的催化剂,在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线图.下列说法错误的是( )| A. | 该催化剂中铁元素的化合价为+3价 | |
| B. | Co、Ni、Fe均为ⅧB族元素 | |
| C. | 由图中信息可知,Co2+、Ni2+两种离子中催化效果较好的是Co2+ | |
| D. | 由图中信息可知,微波水热法制取的催化剂活性更高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
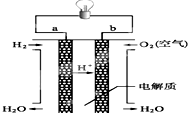 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心理念是对环境污染进行综合治理 | |
| B. | 现代研制的油漆中一般不使用甲醛等化合物,因为这些化合物对人体有害 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com