
| A. | 熔融MgCl2、熔融NaOH | B. | 盐酸、石灰水 | ||
| C. | 石墨、食醋 | D. | 稀硫酸、蔗糖 |
分析 电解质是水溶液中或熔融状态下都导电的化合物,物质导电的条件:存在自由电子或者自由移动的离子,据此解答.
解答 解:A.熔融MgCl2、熔融NaOH,本身能够电离产生自由移动离子而导电,属于电解质,故A选;
B.盐酸是氯化氢气体的水溶液,石灰水是氢氧化钙的水溶液都是混合物,能导电但不是电解质,故B不选;
C.石墨是单质能导电,但不是电解质,食醋是醋酸水溶液,都能导电,但不是电解质,故C不选;
D.蔗糖在水溶液中和熔融状态下都不导电的化合物,属于非电解质,稀硫酸是硫酸溶液,导电但不是电解质,故D不选;
故选A.
点评 本题考查了电解质的判断,熟悉电解质的概念是解题关键,注意电解质一定是化合物,单质、混合物既不是电解质,也不是非电解质,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 小苏打在生活中可用做发酵粉 | |
| B. | 过氧化钠可用于呼吸面具中氧气的来源 | |
| C. | 可溶性铁盐或铝盐可用于净水 | |
| D. | 二氧化硅可用于制作硅芯片和光电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3mol A,2mol B | 6molA.4mol B | 2mol C |
| 达到平衡的时间/时间 | 5 | 8 | |
| A的平衡浓度/mol•L-1 | c1 | c2 | |
| C的体积分数/% | ω1 | ω2 | ω3 |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若x>4,2c1<c2 | |
| B. | 若x=4,则ω1=ω2=ω3 | |
| C. | 只有当x=4时,2ρ1=ρ2 | |
| D. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶于稀盐酸中 CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与盐酸反应 HCO3-+H+═CO2↑+H2O | |
| D. | 氧化铜与盐酸反应 O2-+2H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
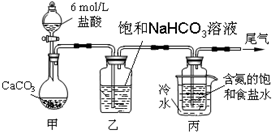
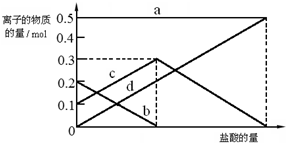
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氟化氢在所有卤化氢中热稳定性最强 | |
| B. | 浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生 | |
| C. | 100ml 0.1 mol•Lˉ1氢氟酸中,c(H+)小于0.1 mol•Lˉ1 | |
| D. | 测得常温下0.1mol•L-1NaF溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com