
| A. | 3种 | B. | 5种 | C. | 8种 | D. | 9种 |
分析 (1)先确定烷烃的碳链异构,即烷烃的同分异构体;
(2)确定烷烃的对称中心,即找出等效的氢原子;
(3)根据先中心后外围的原则,将-OH逐一去代替氢原子. 据此分析.
解答 解:分子式为C5H11OH的同分异构体有
主链有5个碳原子的:CH3CH2CH2CH2CH2OH;CH3CH2CH2CHOHCH3;CH3CH2CHOHCH2CH3;
主链有4个碳原子的:CH3CH(CH3)CH2CH2OH;CH3CH(CH3)CHOHCH3;CH3COH(CH3)CH2CH3;CH2OHCH(CH3)CH2CH3;
主链有3个碳原子的:CH2C(CH3)2CH2OH;
共有8种情况.
故选C.
点评 本题考查同分异构体的种类,根据官能团异构和位置异构和碳链异构来综合分析同分异构体的种数,难度不大,有利于培养学生的逻辑推理能力.


科目:高中化学 来源: 题型:推断题
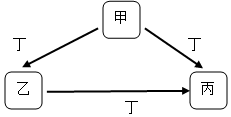 甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).
甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者的pH比后者的大 | 元素非金属性:S>C |
| B | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液,试管口出现红棕色气体 | 溶液中NO被Fe2+还原为NO2 |
| C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
| D | 向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
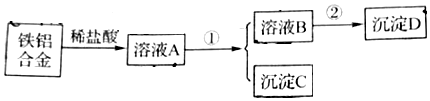
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
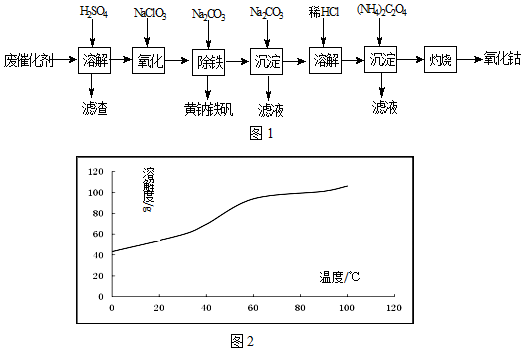
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
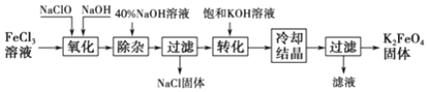
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 欲检验某溶液中含有Fe2+,先向该溶液中加氯水,再加硫氰化钾 | |
| B. | 常温下,铝罐可以用于盛装浓硝酸,利用了浓硝酸的酸性 | |
| C. | Na2O2与水反应可用于制O2,其中Na2O2既做氧化剂又做还原剂 | |
| D. | 可用HF刻蚀玻璃,是因为玻璃中含有的SiO2具有酸性氧化物的通性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为283 kJ | |
| B. | 两个反应都只发生了共价键的断裂和形成 | |
| C. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1023 | |
| D. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509 kJ/mol. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com