

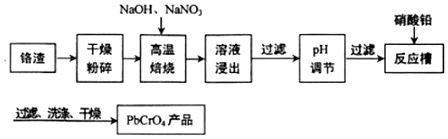
分析 铬铁矿通过焙烧,生成Na2CrO4、NaFeO2、Na2SiO3、NaOH和NaAlO2的混合体系,然后加水溶解得固体氢氧化铁和溶液Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,硅酸盐完全沉淀;继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)铬铁矿主要成分为FeO•Cr2O3,通过焙烧,生成Na2CrO4、NaFeO2;
(2)依据流程图和题干反应分析判断发生的反应及滤液1的成分;
(3)铬酸根在酸性条件下可以转化为重铬酸根;
(4)晶体由转化为溶解度小的转化为溶解度更小的;为不引入杂质硫酸根,用水洗涤;晶体表面附着硫酸根离子,检验洗涤液中是否含有硫酸根即可检验晶体是否洗净.
解答 解:(1)铬铁矿主要成分为FeO•Cr2O3,通过焙烧,生成Na2CrO4、NaFeO2,反应为:4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O;
故答案为:4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O;
(2)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3等杂质,加入氧气和氢氧化钠,发生反应为:
①4FeO•Cr2O3+7O2+20NaOH $\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O;
②2NaOH+Al2O3$\frac{\underline{\;煅烧\;}}{\;}$2NaAlO2+H20;
③2NaOH+SiO2$\frac{\underline{\;煅烧\;}}{\;}$Na2SiO3+H20;
水浸发生NaFeO2的水解:FeO2-+2H2O=OH-+Fe(OH)3↓;操作Ⅰ是过滤,得到滤渣1为Fe(OH)3;滤液1中含Na2CrO4、Na2SiO3、NaOH和NaAlO2;
故答案为:NaAlO2、Na2SiO3;FeO2-+2H2O=OH-+Fe(OH)3↓;
(3)根据题目信息:Cr2O72-+H2O?2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-;
故答案为:(稀)硫酸;
(4)同温下K2Cr2O7晶体的溶解度小于Na2Cr2O7,故向Na2Cr2O7溶液加入K2SO4固体,发生复分解反应而制得K2Cr2O7,为不引入杂质硫酸根,用水洗涤,晶体表面附着硫酸根离子,检验洗涤液中是否含有硫酸根即可检验晶体是否洗净,故方法为:取最后一次洗涤液少许于试管中,加BaCl2溶液,如无白色沉淀,则已洗涤于净;
故答案为:同温下K2Cr2O7晶体的溶解度小于Na2Cr2O7;A;取最后一次洗涤液少许于试管中,加BaCl2溶液,如无白色沉淀,则已洗涤于净.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度较大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子比例模型: | B. | 二 氧化硅的分子式:SiO2 | ||
| C. | 溴化铵的电子式: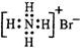 | D. | S2-离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LHCl和0.1mol/LH2SO4与2mol/LNaOH溶液反应速率相同 | |
| B. | 大理石块与大理石粉分别同0.1mol/L盐酸反应速率相同 | |
| C. | Mg、Al在相同条件下分别与0.1mol/L盐酸反应,其反应速率相同 | |
| D. | 0.1mol/LHCl和0.1mol/LHNO3与相同形状和大小的大理石反应,速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量和核电荷数 | B. | 电子层数和中子数 | ||
| C. | 金属性和非金属性的强弱 | D. | 电子层数和最外层电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com