
【题目】25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C.CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)25℃ 101 kPa时,氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为____。
(2)若1g水蒸气转化为液态水放热2.444 kJ,则反应2H2(g)+O2(g)=2H2O(l)的ΔH=___,由此可知氢气的燃烧热为____。(结果保留小数点后一位)
Ⅱ.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,回答下列有关中和反应的问题:
(1)用0.1molBa(OH)2配成稀溶液与足量稀硝酸反应,能放出___kJ的能量。
(2)如图所示装置中,仪器A的名称是___,作用是__;碎泡沫塑料的作用是___。
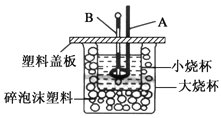
(3)通过实验测定的中和热的ΔH常常大于-57.3kJ/mol,其原因可能是___。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用![]() 和氨水的混合液浸取废铜矿渣中的单质铜,得到
和氨水的混合液浸取废铜矿渣中的单质铜,得到![]() 。某小组同学欲通过实验探究其原理。
。某小组同学欲通过实验探究其原理。
(查阅资料)i.![]() 呈深蓝色,
呈深蓝色,![]() ;受热易分解,放出氨气。
;受热易分解,放出氨气。
ii.![]() 在水溶液中不稳定,
在水溶液中不稳定,![]() 在溶液中只能以
在溶液中只能以![]() 等络合离子的形式稳定存在;
等络合离子的形式稳定存在;![]() 无色,易被氧气氧化为
无色,易被氧气氧化为![]() 。
。
(实验1)制备![]() 。
。
向盛有![]() 溶液的试管中滴加
溶液的试管中滴加![]() 氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到
氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到![]() 晶体。
晶体。
(1)资料表明,向![]() 溶液中滴加氨水,可能会生成浅蓝色
溶液中滴加氨水,可能会生成浅蓝色![]() 沉淀。
沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,____________(补全实验操作和现象),证明沉淀中含有![]() 。
。
②补全实验1中生成![]() 沉淀的离子方程式:
沉淀的离子方程式:
![]() ____________+
____________+![]() ____________
____________
(2)甲同学设计实验证明深蓝色溶液中含![]() :加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
(实验2)探究用![]() 和氨水的混合液浸取单质铜得到
和氨水的混合液浸取单质铜得到![]() 的原理。
的原理。
编号 | 实验装置及部分操作 | 烧杯中溶液 | 实验现象 |
2-1 |
实验开始,先读取电压表示数,后迅速将其换成电流表,继续实验, 10 min内记录甲烧杯中现象 | 甲: 乙: | 电压表指针迅速偏转至0.1V;甲中溶液无明显变化 |
2-2 | 甲: 乙: | 电压表指针迅速偏转至0.3V;甲中溶液无明显变化 | |
2-3 | 甲: 乙:溶液A | 电压表指针迅速偏转至0.35V;甲中溶液无明显变化 | |
2-4 | 甲: 乙: | 电压表指针迅速编转至0.65V;几分钟后,甲烧杯溶液逐渐由无色变蓝色 |
已知:其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大
(3)溶液A为____________。
(4)对比实验2-1和2-2,可以得到结论是____________。
(5)实验2-4中,甲烧杯中溶液由无色变为蓝色的原因是____________。
(6)依据上述实验,分析用![]() 和氨水的混合液浸取单质铜的原理:____________。
和氨水的混合液浸取单质铜的原理:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如下图(甲不一定在丁、庚的连线上),戊、己分别 是空气、地壳中含量最多的元素。下列判断正确的是
![]()
A. 甲一定是金属元素
B. 庚的最高价氧化物水化物酸性最强
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 气态氢化物的稳定性:庚>己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH2CH2CH3(g)+![]() O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+
O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+![]() O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
A.正丁烷与异丁烷的能量大小关系如图
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从镍钼矿渣(主要含有MoO3、NiO、MgO和Fe2O3)中提取元素,其主要工业流程如图:
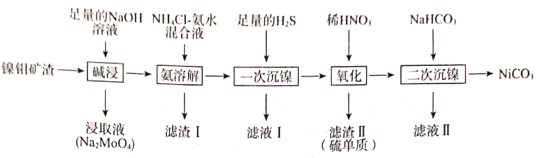
已知:①MoO3难溶于水,可溶于强碱溶液。
②Fe2O3、MgO不溶于NH4Cl—氨水混合液,NiO可溶于NH4Cl—氨水混合液生成[Ni(NH3)6]2+。
③已知部分金属离子形成氢氧化物沉淀的pH见下表:
pH(开始沉淀) | pH(完全沉淀) | |
Fe3+ | 1.52 | 3.18 |
Mg2+ | 8.10 | 9.43 |
请回答下列问题:
(1)“碱浸”时应先将镍钼矿渣粉碎,再与NaOH在80℃下反应2小时,该操作的目的为___。
(2)“碱浸”时,MoO3发生反应的离子方程式为___。
(3)“氨溶解”的目的为___,“氨溶解”过程中反应条件的选择性实验数据如图所示,“氨溶解”过程中需要控制温度在50~70℃之间,温度过高或过低都会导致产品的产量降低,请解释原因___。

(4)简述利用“滤渣I”制备纯净的铁红的方法:___。
(5)“一次沉镍”时加入H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为___。
(6)“氧化”时发生反应的氧化剂与还原剂的物质的量之比为___。
(7)“二次沉镍”时,发生反应的离子方程式为___。
(8)已知:某温度时,Ksp(NiC2O4)=4.0×10-10,Ksp(NiCO3)=1.60×10-8。此温度下,将碳酸镍固体投入到1L一定浓度的Na2C2O4溶液中,若要一次性恰好将1molNiCO3完全转化成NiC2O4,则所需Na2C2O4溶液的浓度c(Na2C2O4)=___(忽略溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol/L NaOH溶液480 mL和1.0 mol/L硫酸溶液250 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
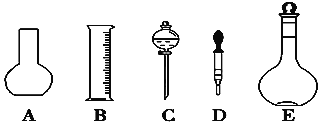
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液 E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.3 mol/L(填“大于”“等于”或“小于”,下同)。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_______mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________ mL的量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某饱和链烃的含氧衍生物X具有如下性质:X+H2O![]() Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
A.10种B.8种C.7种D.6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com