
某同学用回收的镁铝合金制取氢气.现有l0.8g镁铝合金,下列说法正确的是( )
|
| A. | 常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2 |
|
| B. | 常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2 |
|
| C. | 常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol~0.6 mol之间 |
|
| D. | 常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol~0.6 mol之间 |
| 镁的化学性质;化学方程式的有关计算;铝的化学性质.. | |
| 专题: | 极端假设法. |
| 分析: | A、浓硫酸具有强氧化性,铝在浓硫酸中发生钝化,镁与浓硫酸反应生成二氧化硫; B、稀硝酸是氧化性酸,镁、铝与稀硝酸反应生成一氧化氮气体; C、2 mol/L H2SO4为稀硫酸,镁、铝与稀硫酸反应生成氢气,根据极限法判断生成氢气的范围; D、铝与氢氧化钠反应生成氢气,镁与氢氧化钠不反应,根据极限法判断生成氢气的范围. |
| 解答: | 解:A、浓硫酸具有强氧化性,铝在浓硫酸中发生钝化,镁与浓硫酸反应生成二氧化硫,不生成氢气,故A错误; B、稀硝酸是氧化性酸,镁、铝与稀硝酸反应生成一氧化氮气体,不生成氢气,故B错误; C、2 mol/L H2SO4为稀硫酸,镁、铝与稀硫酸反应生成氢气,若l0.8g全是镁,根据电子转移守恒,生成氢气物质的量为 D、镁与氢氧化钠不反应,铝与氢氧化钠反应生成氢气,若l0.8g全是铝,根据电子转移守恒,生成氢气物质的量为 故选C. |
| 点评: | 本题考查金属与硫酸、硝酸的反应,难度不大,注意浓硫酸、硝酸是氧化性酸与金属反应不生成氢气,铝、铁在浓硫酸、浓硫酸中发生钝化. |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6  NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
半 透膜与滤纸一样有许多小孔,但孔径比滤纸小,为证实半透膜只能通过离子和较小的分子,胶体分散质不能通过半透膜。现把10 mL淀粉胶体和50 mL KCl溶液的混合液体加入用半透膜制成的袋内,将此袋浸入蒸馏水中。2 min后,用两支试管各取5 mL烧杯中的液体做如下实验。
透膜与滤纸一样有许多小孔,但孔径比滤纸小,为证实半透膜只能通过离子和较小的分子,胶体分散质不能通过半透膜。现把10 mL淀粉胶体和50 mL KCl溶液的混合液体加入用半透膜制成的袋内,将此袋浸入蒸馏水中。2 min后,用两支试管各取5 mL烧杯中的液体做如下实验。
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是________________________________________________________________________。
(2)向另一支试管里滴加少量碘水,其现象是________________________________________________________________________。
(3)由上述实验现象得出的结论是______________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.Fe2++SO+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH+Fe3++ 2SO+ 2Ba2+ + 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
+ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
C.2Fe3++ 3SO+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3NH+ Fe3++3SO+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面.下列说法正确的是( )
|
| A. | 水、双氧水、水玻璃都是纯净物 |
|
| B. | 石墨和C60互称为同位素 |
|
| C. | 磷酸是强电解质 |
|
| D. | 一定条件下石墨转化为C60是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)fBr2(g)+H2(g).两分钟后,反应达到化学平衡,测知H2浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,下列速率正确的是( )
|
| A. | 0.5 mol•L﹣1•min﹣1 | B. | 2.5 mol•L﹣1•min﹣1 |
|
| C. | 2 mol•L﹣1•min﹣1 | D. | 5 mol•L﹣1•min﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
|
| A. | 漂白粉露置在空气中失效:ClO﹣+CO2+H2O=HClO+HCO3﹣ |
|
| B. | 向NaAlO2溶液中通入过量CO2:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ |
|
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32﹣+2Cl2+3H2O=2SO32﹣+4Cl﹣+6H+ |
|
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+Fe(OH)3=FeO42﹣+3Cl﹣+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO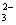 +H2O
+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO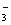
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com