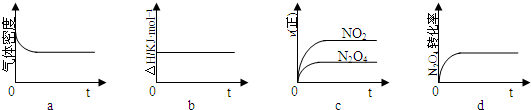ƫ��������N
2O
4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��
��CH
3��
2NNH
2��l��+2N
2O
4��1��=2CO
2��g��+3N
2��g��+4H
2O��g������I��
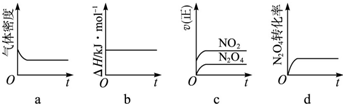
��1����Ӧ��I������������
��
��2������к��г��ֺ���ɫ���壬ԭ��Ϊ��N
2O
4��g���T2NO
2��g�� ����
���¶�����ʱ��������ɫ�����Ӧ����Ϊ
������ȡ����ȡ�����Ӧ��
��3��һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1molN
2O
4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����
��
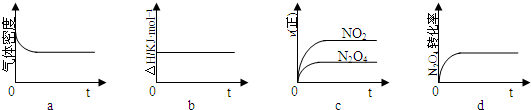
������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ��
������������䡱��С��������Ӧ3s��NO
2�����ʵ���Ϊ0.6mol����0��3s��ƽ����Ӧ����v��N
2O
4��=
mol?L
-1?s
-1��
��4�����᳧��β���к�NO
2��NO��ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ����������ﻹԭΪ������ˮ����Ӧ����Ϊ��
CH
4��g��+4NO
2��g��=4NO��g��+CO
2��g��+2H
2O��g����H=-574kJ?mol
-1CH
4��g��+4NO��g��=2N
2��g��+CO
2��g��+2H
2O��g����H=-1160kJ?mol
-1�����ֱ�ӽ�NO
2��ԭΪN
2���Ȼ�ѧ����ʽΪ��
��
��5�������ڴ�����ȼ�գ�Ҳ������������Ӧ��I�������е����֣���ѧ�����ô�ԭ������Ƴɰ���-����ȼ�ϵ�أ���ͨ�백���ĵ缫��
����������������������������£��õ缫������Ӧ�ĵ缫��ӦʽΪ
��