
| A. | 1:1 | B. | 1:2 | ||
| C. | 2:1 | D. | 有一装置不消耗水,无法比较 |
分析 ①以铜为电极电解Na2SO4溶液,阳极上Cu失电子生成铜离子、阴极上氢离子放电生成氢气,电池反应式为Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑;
②以铂为电极电解Na2SO4溶液,阳极上氢氧根离子放电、阴极上氢离子放电,所以相当于电解水,电池反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑;
根据生成氢气和电解水的关系式计算.
解答 解:①以铜为电极电解Na2SO4溶液,阳极上Cu失电子生成铜离子、阴极上氢离子放电生成氢气,电池反应式为Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑;
②以铂为电极电解Na2SO4溶液,阳极上氢氧根离子放电、阴极上氢离子放电,所以相当于电解水,电池反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑;
根据方程式知,生成相同质量的氢气时消耗水的质量为2:1,
故选C.
点评 本题考查电解原理,为高频考点,明确各个电极发生的反应是解本题关键,易错点是①中发生的反应,注意:活性电极作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 23gNa与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4L N2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaHCO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO32-)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成 | 该酸雨试样中一定含有H2SO4 |
| B | 将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡 | 形成的原电池中锌作负极,银作正极 |
| C | 某无色溶液,加银氨溶液,水浴加热,有银镜生成 | 溶液中一定含有醛类化合物 |
| D | 配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe2+水解,并防止Fe2+被氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能与金属反应,生成高价金属盐 | |
| B. | 新制的氯水中加入AgNO3溶液,有白色沉淀生成 | |
| C. | 欲除去CO2中的大量HCl气体,可将此混合气体通过盛有饱和NaHCO3溶液的洗气瓶 | |
| D. | 漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块浮在液面上,四处游走 | |
| B. | 钠块熔化成小球,逐渐减小最后消失 | |
| C. | 产生蓝色沉淀且出现暗斑 | |
| D. | 烧杯底部析出暗红色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
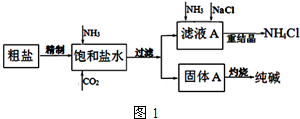 纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com