
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
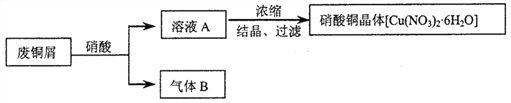
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
【答案】 5∶2 11mol·L-1 将生成的气体B和空气混合,再用水吸收重新利用(或将铜屑在空气中充分加热氧化,再用硝酸溶解)
【解析】(1)①废铜屑中铜和氧化铜的物质的量分别是xmol、ymol,则64x+80y=24;混合气体的物质的量是6.72L÷22.4L/mol=0.3mol,其中NO2和NO的体积比为2∶1,则NO2和NO的物质的量分别是0.2mol、0.1mol,根据电子得失守恒可知2x=0.2×1+0.1×3,解得x=0.25,所以y=0.1,因此废铜屑中铜和氧化铜的物质的量之比5∶2。②若测得溶液A中H+的浓度为1mol·L-1,即剩余硝酸的物质的量是0.1mol,生成硝酸铜是0.35mol,所以根据氮原子守恒可知原硝酸的物质的量浓度为(0.1+0.35×2+0.3)mol÷0.1L=11mol·L-1;(2)要防止原料的浪费,避免污染环境可以将生成的气体B和空气混合,再用水吸收重新利用或将铜屑在空气中充分加热氧化,再用硝酸溶解。


科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
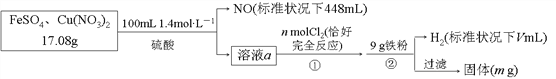
下列叙述中不正确的是( )
A. n=0.02 B. m=3.2
C. V=2240 D. 原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )
A.硫在空气中燃烧
B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应
D.亚硫酸钠与较大浓度硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排酸性废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
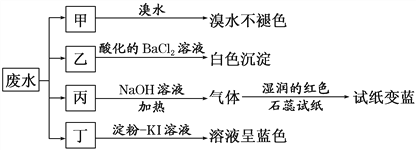
已知:废水试样中除H+外可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是________________(填化学式,下同),离子Y是________________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为____________________________________________________________________________。
(3)写出废水试样中滴加淀粉KI溶液所发生反应的离子方程式: _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
已知:酸性强弱:H2SO3>H2CO3>HClO
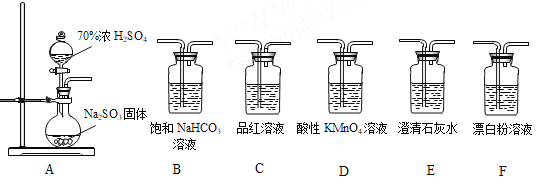
(1)装置A中反应的化学方程式为________________________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→( )→( ) →C→F。________
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过_______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_______________。
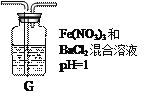
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO![]() 氧化;
氧化;
原因二:SO2被Fe3+氧化;
原因三:________________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙烯、苯均能与H2发生加成反应,说明两者均含碳碳双键
B.相同质量的烃完全燃烧,耗氧量最大的是CH4
C.相同质量的乙炔、苯分别在足量氧气中燃烧,苯比乙炔消耗的氧气质量多
D.乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法正确的是
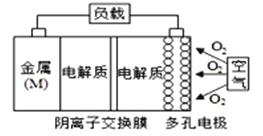
A. 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
B. M-空气电也放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
C. Al作电极材料时电解质溶液最好选酸性,这样更有利于反应的发生,同时防止负极区沉淀
D. 在Mg-空气电也中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com